Hohlkathodenlampe
Eine Hohlkathodenlampe (HKL) ist eine spezielle Bauform einer Glimmlampe, eine Form von Gasentladungsröhre, welche primär als optische Strahlungsquelle in einem Atomabsorptionsspektrometer (AAS) im Rahmen der instrumentellen Analytik eingesetzt wird. Die Hohlkathodenlampe fungiert im Atomabsorptionsspektrometer als Referenzlichtquelle mit einem definierten Lichtspektrum. Dieses genaue und bekannte Lichtspektrum hängt primär vom verwendeten Material an der Kathode der Lampe ab.[1]

Aufbau
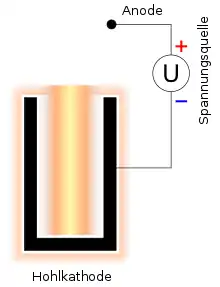
Wesentlicher Bestandteil einer Hohlkathodenlampe ist die spezielle Bauform der Kathode, welche aus einem kleinen metallischen Gefäß (Topf) geformt ist und, wie in nebenstehender Schnittdarstellung dargestellt, nach oben hin offen ist. Wie bei jeder Glimmlampe befindet sich neben der Kathode die Anode als zusätzliche Elektrode in einem üblicherweise mit Edelgas bei Unterdruck gefüllten Glaskörper. Auf einer Seite des äußeren Glaskörpers befindet sich ein spezieller Lampensockel für die Aufnahme der elektrischen Anschlüsse und die Halterung im AAS, auf der anderen Seite der mit Quarzglas abgedeckte Strahlenausgang.
Bei Anlegen einer hohen Gleichspannung aus einer Spannungsquelle im Bereich von einigen 100 V bei Stromstärken von einigen 10 mA kommt es zwischen der Kathode und der Anode zu einer Glimmentladung. Die Plasmadichte einer Glimmentladung ist aber für die Anwendung als Referenzlichtquelle in einem Atomabsorptionsspektrometer um einige Zehnerpotenzen zu gering – die nötige hohe Plasmadichte würde bei einer stabförmigen Kathode erst bei einer Bogenentladung auftreten, welche bei einer herkömmlichen Glimmlampe zur thermischen Zerstörung der Lampe führen würde. Abhilfe stellt die Form einer Hohlkathode dar.
Durch die Formung der Hohlkathode können im Innenbereich der Kathode deutlich weniger Ionen und Elektronen in den Außenbereich der Lampe diffundieren und dort durch Rekombination für das Plasma verloren gehen. Ein weiterer Effekt zur Steigerung der Plasmadichte ist durch die veränderte elektrische Potentialverteilung in der Hohlkathode bedingt, welche zu einer längeren Verweildauer von Ionen im Innenbereich führt. Primär durch diese beiden Effekte können im Inneren der Hohlkathode hohe Plasmadichten entstehen, ohne dass die hohe Leistungsdichte einer Bogenentladung benötigt würde.
Anwendung

In der Atomabsorptionsspektrometrie werden elementspezifische Hohlkathodenlampen verwendet, die Kathode besteht aus dem Element des Analyten. Aus diesem Grund befinden sich in Analysegeräte meist eine größere Anzahl verschiedener Hohlkathodenlampen, welche in einer Revolvervorrichtung für den jeweiligen Analyseschritt gewählt werden können.[2] Alternativ können zur AAS auch elektrodenlose Induktionslampen eingesetzt werden, denn normale Hohlkathodenlampen zeigen unterhalb etwa 300 nm eine deutliche Intensitätsverschlechterung ihrer Emissionslinien.
Im Ultraspurenbereich weist man mit Hilfe eines Atomabsorptionsspektrometers mit Zinn-Hohlkathodenlampe z. B. Zinn nach (Graphitrohr- und Hydridtechnik der Atomspektrometrie), wobei mit der Graphitrohr-Atomabsorptionsspektrometrie Nachweisgrenzen von 0,2 µg/l erreicht werden. In der Hydridtechnik werden die Zinnverbindungen der Probelösung mittels Natriumborhydrid als gasförmiges Stannan (Zinnwasserstoff) in die Quarzküvette des Atomabsorptionsspektrometers überführt. Dort zerfällt das Stannan bei ca. 1000 °C in die Elemente, wobei der atomare Zinndampf spezifisch die Zinn-Linien einer Zinn-Hohlkathodenlampe absorbiert. Hier sind 0,5 µg/l als Nachweisgrenze angegeben worden.[3]
Weblinks
Einzelnachweise
- Hohlkathoden-Glimmentladung. Fraunhofer IST, 2010, abgerufen am 8. Februar 2014.
- Markus Enders, Beate Termin: Atomabsorptions-Spektroskopie. (Nicht mehr online verfügbar.) Uni-Heidelberg, 2002, archiviert vom Original am 19. März 2013; abgerufen am 8. Februar 2014. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- K. Cammann (Hrsg.), Instrumentelle Analytische Chemie, Spektrum Akademischer Verlag, Heidelberg-Berlin, 2001, S. 4–47.