Heron-Umlagerung
Die Heron-Umlagerung ist eine Namensreaktion aus dem Bereich der Organischen Chemie, die 1994 erstmals durch den Chemiker Stephen A. Glover auf der zweiten Heron Island Conference on Reactive Intermediates and Unusual Molecule in Australien der Öffentlichkeit vorgestellt wurde.[1] Daher stammt auch der Name Heron-Umlagerung.[2] Chemisch ist es eine Umsetzung eines Amids mit zwei Substituenten mit Heteroatomen am Stickstoffatom zu einem Ester und einem 1,1-Diimin. Das Hauptprodukt ist dabei der Ester.[3]
Übersicht
Ein am Stickstoffatom durch zwei Heteroatome substituiertes Amid, hier durch ein Bromatom und eine Alkoxygruppe substituiert, wird mit einem Amin zu einem Ester und einem 1,1-Diimin umgesetzt.[4]
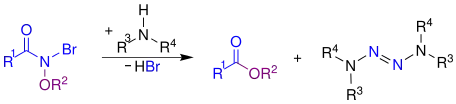
Es findet eine Umlagerung der Alkoholatgruppe vom Stickstoffatom zum Carbonylkohlenstoffatom und eine SN2-Reaktion statt.[4]
Statt eines N-Alkoxy-N-bromamids kann auch ein N-Alkoxy-N-chloramid als Edukt eingesetzt werden.[5] Auch die Verwendung eines N-Acyloxy-N-alkoxyamids statt eines N-Alkoxy-N-halogenamids wird in der Literatur unter dem Begriff Heron-Umlagerung behandelt.[6]
Reaktionsmechanismus
Die nachfolgende Darstellung beschreibt einen Vorschlag für den Reaktionsmechanismus:[4]
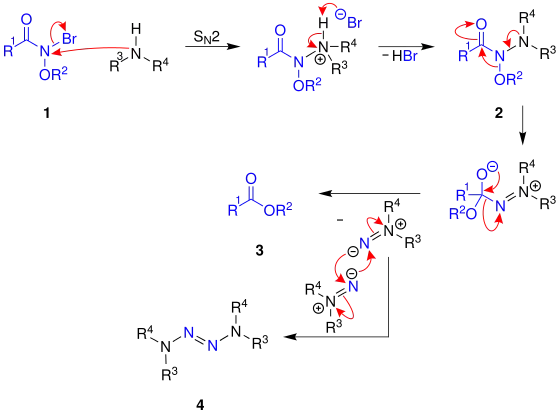
Zuerst findet eine SN2-Reaktion zwischen einem Amid 1 und einem Amin statt. Anschließend deprotoniert die Abgangsgruppe der SN2-Reaktion, hier ein Bromidanion, das entstandene Proton am Aminstickstoffatom. So entsteht die Distickstoffverbindung 2. Anschließend findet die Umlagerung der Alkoxygruppe (OR1) vom Stickstoffatom zum Carbonylkohlenstoffatom statt. Nach der Abspaltung eines in 1-Position disubstituierten Diimins entsteht der Ester 3. Außerdem können jeweils zwei Moleküle des Diimins zu einem Molekül eines 1,1-Diimins 4 umgesetzt werden.[4]
Einzelnachweise
- Stephen A. Glover, Gerard P. Hammond, Antonio M. Bonin: A Comparison of the Reactivity and Mutagenicity of N-(Benzoyloxy)-N-(benzyloxy)benzamides. In: The Journal of Organic Chemistry. Band 63, Nr. 26, Dezember 1998, S. 9684–9689, doi:10.1021/jo980863z.
- Stephen A. Glover, Guoning Mo: Hindered ester formation by SN2 azidation of N-acetoxy-N-alkoxyamides and N-alkoxy-N-chloroamides—novel application of HERON rearrangements. In: Journal of the Chemical Society, Perkin Transactions 2. Nr. 10, Oktober 2002, S. 1728–1739, doi:10.1039/B111250N.
- Stephen A. Glover, Arvi Rauk: Conformational Stereochemistry of the HERON Amide, N-Methoxy-N-dimethylaminoformamide: A Theoretical Study. In: The Journal of Organic Chemistry. Band 64, Nr. 7, April 1999, S. 2340–2345, doi:10.1021/jo982048p.
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 3 Volume Set, John Wiley & Sons, Hoboken, New Jersey, 2009, ISBN 978-0-471-70450-8, S. 1392–1393.
- Stephen A. Glover: Anomeric amides — Structure, properties and reactivity. In: Tetrahedron. Band 54, Nr. 26, 25. Juni 1998, S. 7229–7271, doi:10.1016/S0040-4020(98)00197-5.
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006, ISBN 978-0-911910-00-1, S. ONR-43.