Estradiol-17β-Dehydrogenase
Die Estradiol-17β-Dehydrogenase (17β-HSD-1) ist das Enzym, das den letzten Schritt in der Biosynthese von Estradiol katalysiert, die Hydrierung von Estron. Die Reaktion findet in Wirbeltieren im Zytosol statt; homologe Proteine ohne bekannte Funktion finden sich aber auch in Bakterien und Pilzen.
| Estradiol-17β-Dehydrogenase | ||
|---|---|---|
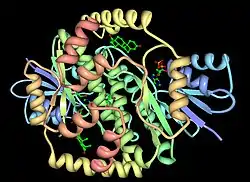 | ||
| Modell der 17β-HSD Typ 1 mit Androstendion und NADP[1] | ||
|
Vorhandene Strukturdaten: 1A27, 1BHS, 1DHT, 1EQU, 1FDS, 1FDT, 1FDU, 1FDV, 1FDW, 1I5R, 1IOL, 1JTV, 1QYV, 1QYW, 1QYX, 3DEY, 3DHE, 3HB4, 3HB5, 3KLM, 3KLP, 3KM0 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 328 Aminosäuren | |
| Kofaktor | NADPH | |
| Bezeichner | ||
| Gen-Namen | HSD17B1 EDH17B2; EDHB17; HSD17; SDR28C1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.1.1.62, Oxidoreduktase | |
| Reaktionsart | Hydrierung | |
| Substrat | Estron + NADPH/H+ | |
| Produkte | Estradiol + NADP+ | |
| Vorkommen | ||
| Übergeordnetes Taxon | Tiere (Vertebraten), Protein unbekannter Funktion in Pilzen und Bakterien | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 3292 | 15485 |
| Ensembl | ENSG00000108786 | ENSMUSG00000019301 |
| UniProt | P14061 | P51656 |
| Refseq (mRNA) | NM_000413 | NM_010475 |
| Refseq (Protein) | NP_000404 | NP_034605 |
| Genlocus | Chr 17: 42.55 – 42.56 Mb | Chr 11: 101.08 – 101.08 Mb |
| PubMed-Suche | 3292 | 15485 |
Das Dimer, wie in der Abbildung gezeigt, ist die aktive Enzymform. Monomere können die Reaktion nicht katalysieren.
Die 17β-HSD Typ 1 wird in den follikulären Granulosa-Zellen der Gonaden, in der Brustdrüse und in der Plazenta exprimiert. Ihr Fehlen in der Nebenniere fördert die Androgen-Bildung dort. Nach dem Eisprung bildet sich das Follikel zum Gelbkörper um, der weiterhin Estradiol bildet. Für diese Estradiol-Bildung ist nicht mehr die zytosolische 17β-HSD Typ 1, sondern die mikrosomale 17β-HSD Typ 7 verantwortlich.[2]
Die Verfügbarkeit von Estradiol in Brusttumoren, das durch Umwandlung von Estron durch die 17β-HSD Typ 1 entsteht, ist ein wichtiger Tumorwachstumsfaktor. Daher werden Inhibitoren des Enzyms als Tumorhemmstoffe untersucht.[3]
Grundsätzlich könnten alle Hydroxysteroid-Dehydrogenasen auch die Rückreaktion katalysieren, aber für die Oxidation von Estradiol sind andere Subtypen von 17β-HSD verantwortlich.
Katalysierte Reaktion
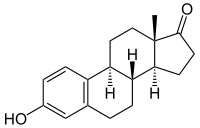 + NADPH/H+ →
+ NADPH/H+ → 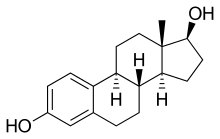 + NADP+
+ NADP+
Estron wird zu Estradiol reduziert.
Einzelnachweise
- Shi R, Lin SX: Cofactor hydrogen bonding onto the protein main chain is conserved in the short chain dehydrogenase/reductase family and contributes to nicotinamide orientation. In: J Biol Chem. 279, Nr. 16, Dezember, S. 16778–16785. doi:10.1074/jbc.M313156200. PMID 14966133.
- Payne AG, Hales DB: Overview of Steroidogenic Enzymes in the Pathway from Cholesterol to Active Steroid Hormones. In: Endocrine Reviews. 25, Nr. 6, 2004, S. 947–970. doi:10.1210/er.2003-0030. PMID 15583024.
- Purohit A, Tutill HJ, Day JM, Chander SK, Lawrence HR, Allan GM, Fischer DS, Vicker N, Newman SP, Potter BV, Reed MJ: The regulation and inhibition of 17beta-hydroxysteroid dehydrogenase in breast cancer. In: Mol Cell Endocrinol. 248, Nr. 1–2, Dezember, S. 199–203. doi:10.1016/j.mce.2005.12.003. PMID 16414180.