Enteropeptidase
Enteropeptidase oder (veraltet und nach biochemischer Nomenklatur irreführend, da das Enzym keine Phosphorylierung katalysiert) Enterokinase, ist ein Enzym im Bürstensaum der Wirbeltiere, welches von der Duodenalschleimhaut gebildet wird. Durch Abspaltung eines Hexapeptids (Val-[Asp]4-Lys) wandelt die membrangebundene Enteropeptidase das inaktive Proenzym Trypsinogen in dessen aktive Form Trypsin um, wodurch es indirekt weitere Enzyme des Pankreassekrets aktiviert.
| Enteropeptidase | ||
|---|---|---|
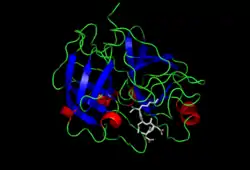 | ||
| Bändermodell nach PDB 1EKB | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 1019 = 784+235 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Heterodimer | |
| Bezeichner | ||
| Gen-Namen | PRSS7 ; ENTK | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.21.9, Serinprotease | |
| MEROPS | S01.156 | |
| Reaktionsart | Hydrolyse | |
| Substrat | Trypsinogen | |
| Produkte | Trypsin + Hexapeptid (Val-[Asp]4-Lys) | |
| Vorkommen | ||
| Homologie-Familie | PRSS7 | |
| Übergeordnetes Taxon | Euteleostomi | |
Die Enteropeptidase katalysiert folgende Reaktion:
- Trypsinogen → Trypsin + Hexapeptid
Quellen
- Roche, Lexikon der Medizin, 5. Auflage (http://www.tk-online.de/rochelexikon/)
- Robert F. Schmidt, Florian Lang: Physiologie des Menschen mit Pathophysiologie; Springer Medizin Verlag, Heidelberg, 30. Auflage 2007
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.