Doppelzahnweih
Der Doppelzahnweih (Harpagus bidentatus), gelegentlich auch als Rostbrust-Zahnhabicht bezeichnet[1], ist ein kleiner Greifvogel aus der Familie der Habichtartigen. Die Art ist ein Bewohner dichter, naturbelassener Wälder in Süd- und Mittelamerika, wo sie Jagd auf Insekten und Reptilien macht. Bemerkenswert ist das Jagdverhalten einiger Exemplare, die sich auf die Verfolgung von Affengruppen und den Verzehr von durch diese Affen aufgeschreckten Beutetieren spezialisiert haben. Doppelzahnweihe gelten derzeit in ihrem Fortbestehen allgemein als nicht bedroht, ihr Lebensraum schrumpft jedoch stetig auf Grund der fortschreitenden Abholzung der Wälder in der Region. Trotz des großen Verbreitungsgebiets und regelmäßiger Sichtungen auf Gleitflügen über dem Blätterdach ist die Art bislang nur wenig erforscht.
| Doppelzahnweih | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

Doppelzahnweih (Harpagus bidentatus) | ||||||||||
| Systematik | ||||||||||
| ||||||||||
| Wissenschaftlicher Name | ||||||||||
| Harpagus bidentatus | ||||||||||
| (Latham, 1790) |
Merkmale
Körperbau und Aussehen
Der Doppelzahnweih gehört mit einer Größe zwischen 29 und 35 cm und einer Flügelspannweite von 60 bis 72 cm zu den kleineren Vertretern seiner Familie.[2] Wie bei vielen Greifvögeln liegt auch beim Doppelzahnweih ein deutlicher Sexualdimorphismus hinsichtlich Größe und Gewicht vor. So werden Weibchen im Schnitt 15 bis 20 % größer als ihre männlichen Artgenossen. Ihr Gewicht bewegt sich im Bereich von 196 bis 207 g, während Männchen nur 161 bis 185 g erreichen können. Der Körperbau erinnert mit verhältnismäßig kurzen, aber breiten und abgerundeten Flügeln, einem langen Schwanz und einem kleinen, stark gebogenen Schnabel an einen typischen Habicht oder Sperber. Am Schneidrand der oberen Mandibel des Schnabels finden sich zwei zahnartige Vorsprünge, auf die sich auch der Trivialname der Art bezieht und die vermutlich zum Zerteilen der Beute genutzt werden. Wie bei den Körpermaßen zeigt sich auch bei der Färbung des Gefieders ein erkennbarer, jedoch weniger ausgeprägter Sexualdimorphismus. Bei männlichen Exemplaren sind der Rücken sowie die Oberseite der Flügel in einem trüben Grau-Braun gefärbt. Nacken, Haube und Kopf sind etwas heller und tendieren eher zu einem leicht bläulich schimmernden Grauton. Die Kehle ist hingegen perlweiß gefärbt, in ihrer Mitte verläuft vertikal ein schmaler, schwarzer Streifen. Brust, Bauch und Flanken sowie die befiederten Schenkel zeigen eine rotbraune bis gräuliche Grundfärbung, die von einer dunkleren Sperberung unterbrochen wird. Bei einigen Individuen ist diese Musterung jedoch so schwach ausgeprägt, dass sie kaum oder nur aus der Nähe erkennbar ist. Die Unterschwanzfedern sind wiederum weiß gefärbt, besonders in sitzender Haltung wirken sie außerdem flauschig und erinnern an Daunen. Die Steuerfedern sind ähnlich dunkel gefärbt wie der Rückenbereich, zeigen jedoch an der Oberseite drei schmale, weiße (innere Federn) oder graue (äußere Federn) Bänder. An ihrer Unterseite finden sich hingegen nur zwei weiße Bänder, die jeweils von einer breiteren gräulichen Färbung umgeben sind. Die Unterseite der Flügel ist deutlich heller als die Oberseite, Hand- und Armschwingen sind ebenso wie die Armdecken weiß gefärbt und dunkel gesäumt, während die Handdecken ungemustert weiß sind. Im Flug entsteht durch diese Färbung der Eindruck mehrerer unvollständiger, dunkler Bögen an den ansonsten weißen Flügeln. Wachshaut, Zügel und Augenringe sind gelblich und zeigen gelegentlich leicht grünliche Einschläge. Die Iris des Auges ist orange bis rot-orange. Der Schnabel ist an der Basis gelblich und im weiteren Verlauf gräulich-schwarz gefärbt. Die kräftigen, unbefiederten Beine und Füße sind wiederum gelblich und enden in langen, stark gebogenen Klauen. Weibliche Doppelzahnweihe unterscheiden sich vor allem durch die Färbung an der Unterseite von männlichen Exemplaren. Bei ihnen ist die rotbraune Grundfarbe an diesen Stellen von einer viel ausgeprägteren, aber nicht dunklen, sondern weißen Sperberung unterbrochen. Darüber hinaus wirkt bei weiblichen Vögeln der Rückenbereich durch einen hellen Saum der Konturfedern allgemein etwas heller.[3]
Jungvögel
Doppelzahnweihe, die noch das Jugendkleid tragen, sind an der Oberseite eher braun als grau-braun gefärbt. Im Nacken und an der Haube zeigt sich ein vertikales Muster weißer Streifen, das von Vogel zu Vogel unterschiedlich ausgeprägt sein kann. Die Konturfedern am Mantel besitzen blassere Säume. Die größten Unterschiede zu den Adulten finden sich an der Unterseite, wo die Brust, der Bauch und bei vielen Exemplaren auch die Flanken noch cremeweiß gefärbt sind. Rötlich-braune Farbtöne finden sich wenn überhaupt nur im Bereich der Flanken, sind jedoch eher selten. Die gesamte Unterseite ist darüber hinaus von einem braunen Streifenmuster variabler Ausprägung durchzogen. Die Bänderung an den Flügeln ist oft noch unvollständig und auch im Flug weniger deutlich sichtbar als bei älteren Individuen.[3]
Verwechslungskandidaten
Auf Grund des habicht- oder sperberartigen Körperbaus kann der Doppelzahnweih auf größere Entfernungen leicht mit ähnlich großen Arten wie dem Zweifarben- (Accipiter bicolor) oder dem Eckschwanzsperber (A. striatus) verwechselt werden, die beide eine sehr variable und verwirrende Gefiederfärbung aufweisen. Beide Arten besitzen jedoch kürzere Flügel und längere Beine als der Doppelzahnweih und zeigen des Weiteren ein viel schüchterneres und schreckhafteres Verhalten. Darüber hinaus kommen einige weitere Arten als mögliche Verwechslungskandidaten in Frage, die sich aber alle anhand mehr oder weniger offensichtlicher Abweichungen bei der Gefiederfärbung unterscheiden lassen. Zu nennen sind hier beispielsweise der Sperberwaldfalke (Micrastur ruficollis), der Langschnabelweih (Chondrohierax uncinatus) und der Wegebussard (Rupornis magnirostris).[3] Bei der großen Ähnlichkeit zu einigen der größeren, teilweise vogelfressenden Accipiter-Arten könnte es sich auch um eine Form von Mimikry durch den Doppelzahnweih handeln, der dadurch möglicherweise potenzielle Fressfeinde abzuschrecken versucht.[4]
Habitat und Verhalten
Der bevorzugte Lebensraum des Doppelzahnweihs sind primäre, tropische Regenwälder mit einem dichten Blätterdach und eher spärlichem Unterwuchs. Jagdversuche finden oft tief im Inneren des Waldes statt, generell meidet die Art außerhalb der Brutzeit offenbar Übergänge zu offenem Terrain oder Sekundärwald.[5] Offenere Landschaftsformen wie verbuschtes Waldland oder Mangroven werden jedoch zumindest in Ausnahmefällen oder saisonal begrenzt besiedelt, wie beispielsweise Beobachtungen von der Insel Ambergris Caye vor der Küste von Belize zeigen.[6] Verhalten und Lebensweise des Doppelzahnweihs sind, wie bei vielen waldbewohnenden Greifvögeln der Neotropis, bislang wenig umfassend erforscht. Detaillierte Informationen entstammen zumeist einer einzelnen langfristig angelegten Studie aus Guatemala, am nördlichen Rand des Verbreitungsgebiets. Ob alle bekannten Daten für die Gesamtheit der Population übertragbar sind, ist daher zumindest ungewiss.[7] An Ruheplätzen oder während der Jagd innerhalb des Waldes sind die Vögel eher unauffällig und entsprechend schwierig zu beobachten. Anders verhält es sich bei den ausgedehnten, morgendlichen Segelflügen über dem Blätterdach, die vermutlich zur Abgrenzung des eigenen Territoriums gegenüber Artgenossen dienen sollen. Darüber hinaus könnten sie eine Funktion während der Balz oder bei der Paarbindung erfüllen. Hierbei steigen die Vögel in Höhen von bis zu 300 m auf, um dann plötzlich in spektakulär anzusehende Sturzflüge überzugehen, bei denen sie teilweise durch die Baumkronen tauchen und innerhalb des Waldes landen. Die Größe der Territorien ist nur für einen einzelnen Fall belegt, bei dem sich ein Weibchen über mehrere Monate in einem Aktionsradius von etwa 2 km² um den eigenen Nistplatz herum bewegte. Territoriale Konflikte zwischen einzelnen Doppelzahnweihen oder Paaren konnten bislang nicht direkt beobachtet werden.[8] Gesichtet werden die Vögel zumeist allein oder in Paaren, nur selten kann es offenbar auch zur Bildung kleiner, loser Gruppenverbände kommen.[3] Bei einem Großteil der Art handelt es sich sehr wahrscheinlich um Standvögel, wobei einzelne Beobachtungen auf ein Zug- oder nomadisches Wanderverhalten zumindest einzelner Individuen hindeuten könnten. So sind die erwähnten Sichtungen von Ambergris Caye bislang nur im Frühjahr gemacht worden.[4] Des Weiteren liegen jeweils gut dokumentierte Einzelsichtungen aus den US-Bundesstaaten Texas[9] und Florida vor.[10] Darüber hinaus ist von der Population, die die erste Jahreshälfte auf der Insel Trinidad verbringt, bekannt, dass sie in den Monaten Juli bis Dezember auf dem südamerikanischen Festland anzutreffen ist.[3]
Ernährung und Jagdverhalten
Doppelzahnweihe sind reine Fleischfresser, deren Nahrung fast ausschließlich aus Insekten und kleinen Eidechsen besteht. Die genaue Zusammensetzung der Nahrung kann variieren; typischerweise machen Insekten aber circa 60 % der Ernährung aus, während etwas weniger als 40 % auf die Eidechsen entfallen. Ergänzend werden bei entsprechender Gelegenheit andere Reptilien, Vögel, Fledermäuse und Nagetiere geschlagen. Unter den Insekten sind verschiedene Zikaden mit mehr als 80 % vertreten; Grashüpfer, Wespen, Raupen, Kakerlaken oder Käfer werden in deutlich kleineren Mengen erbeutet. Unter den Echsen sind vor allem verschiedene Arten der Gattung Anolis überproportional stark vertreten. Ältere Angaben, denen zufolge die Art fast ausschließlich Vögel fräße, wurden durch neuere Forschungen als falsch widerlegt. Vermutlich basierte diese Annahme auf einem Bericht zweier Vogelsammler aus den 1920er-Jahren, die ein gefangenes Exemplar über mehrere Monate hinweg ausschließlich mit Vogelkadavern gefüttert hatten. Alle bislang beobachteten Jagdversuche fanden innerhalb des Waldes statt; aus dem eigenen Gleitflug heraus scheint die Art hingegen nicht zu jagen. Die bevorzugte Methode der meisten Doppelzahnweihe scheint die Lauerjagd zu sein, bei der die Vögel an einer Sitzwarte geduldig auf vorbeikommende Beute warten. Wurde ein passendes Beutetier erspäht, wird dieses, so es sich um ein fliegendes Tier handelt, nach einem kurzen Verfolgungsflug mit den Klauen geschlagen. Befindet sich das Ziel am Boden oder innerhalb der Vegetation, stürzen sich die Vögel mit einem direkten, schnellen Schwung in teilweise spitzem Winkel darauf. Eidechsen werden gelegentlich auch mit ausgebreiteten Flügeln rennend über Äste und Baumstämme verfolgt.[11] Eine eher ungewöhnliche Jagdmethode wurde bei einem Doppelzahnweih in Guatemala beobachtet, der an einer Doline während der Jagd auf Fledermäuse der Gattung Artibeus gesichtet wurde. Dieses Exemplar startete seine Jagd von einer Sitzwarte etwa 10 m unterhalb der fliegenden Fledermäuse, stieg steil zu diesen auf und griff die Beute schließlich am Höhepunkt einer Rückwärtsrolle in der Luft.[12] Darüber hinaus sind Doppelzahnweihe dafür bekannt, Gruppen verschiedener Affenarten über längere Zeiträume auf deren Streifzügen durch den Wald zu folgen und von diesen aufgescheuchte Insekten und Reptilien zu erbeuten. Hierfür wählen sie bevorzugt kleinere, aktive Arten wie Weißschulter-Kapuziner- (Cebus capucinus) und Gewöhnliche Totenkopfaffen (Saimiri sciureus) aus, die bei der eigenen Futtersuche größere Strecken zurücklegen und selten länger an ein und demselben Ort verbleiben.[13] Bei diesem Verhalten scheint es sich um eine rein parasitäre Beziehung zu handeln, von der nur die Doppelzahnweihe profitieren. Werden sie von den Affen bemerkt, versuchen diese die Vögel durch lautes Rufen und Drohgebärden zu vertreiben. Sind die Affen nicht aktiv genug und scheuchen zu wenig potenzielle Beute auf, kann es vorkommen, dass ein Doppelzahnweih in der Luft direkt über einem der Affen schwebt und diesen so lange mit seinen Klauen tritt, bis die Gruppe sich wieder in Bewegung setzt.[4] Der bei den bisher beobachteten Versuchen festgestellte prozentuale Anteil erfolgreicher Jagden ist mit etwa 73 % recht hoch, beruht jedoch auf vergleichsweise wenigen Daten und könnte daher in der Zukunft noch nach unten korrigiert werden müssen.[14]
Fortpflanzung
Der Zeitraum der Brutzeit ist regional unterschiedlich und scheint jeweils gegen Ende der Trockenzeit zu beginnen, damit das Schlüpfen der Eier in etwa mit dem Beginn der Regenzeit zusammenfällt. In Mittelamerika wurden Doppelzahnweihe beim Nestbau in den Monaten April und Mai beobachtet[15], während in Kolumbien[3] und Panama das Brutgeschäft bereits im Januar zu beginnen scheint.[4] Das Balzverhalten der Art besteht offenbar größtenteils aus gemeinsamen Gleitflügen in geringer Entfernung zueinander, unterbrochen von den oben beschriebenen, plötzlichen Sturzflügen. Vor der Kopulation kommt es häufig zur Übergabe von Nahrung vom Männchen an seine Partnerin, die diese manchmal auch während des Geschlechtsverkehrs verzehrt. Diese ritualisierten Nahrungsübergaben werden oft auch noch während der Nestbauphase beobachtet. Hierbei landet das Männchen nach erfolgreicher Jagd in etwa 10 bis 20 m Entfernung zum Nistplatz und ruft das Weibchen anschließend mit einer bestimmten Lautäußerung zu sich. Als Nistplatz wählen die Vögel häufig Bäume mit besonders wenig Bewuchs durch Ranken und andere Epiphyten, die bevorzugt an den Rändern von Lichtungen stehen und damit wenig Kontakt zur umgebenden Vegetation aufweisen. Der Grund dafür wird in einer reduzierten Prädation durch Nesträuber vermutet, da diese den Nistplatz so schwieriger erklettern können. Besondere Präferenzen für bestimmte Baumarten bestehen hingegen offenbar nicht. Das Nest selbst wird in einer Höhe von mehr als 20 m in einer Astgabel unterhalb der Krone errichtet und besteht aus kleinen Stöcken von 20 bis 40 cm Länge, die zu einer flachen, tassenförmigen Konstruktion arrangiert werden. Sein Durchmesser liegt bei durchschnittlich 32 cm, die Tiefe beträgt ungefähr 10 cm. Der eigentliche Bau des Nests obliegt fast ausschließlich dem Weibchen, Männchen werden nur selten dabei gesichtet, wie sie einzelne Stöcke zur Konstruktion beitragen. Nach der Fertigstellung des Nests beginnt das Weibchen mit der Eiablage. Das Gelege besteht in der Regel aus zwei Eiern, seltener kommen auch ein einzelnes bzw. in Ausnahmefällen drei Eier vor. Die Abmessungen der Eier sind nur für ein einzelnes, in einer Museumssammlung befindliches Gelege dokumentiert. Sie liegen zwischen 36,5 und 42,1 × 31,0 und 31,6 mm. Das geschätzte Lebendgewicht beträgt etwa 21,5 g.[16] Die Schale ist in ihrer Grundfarbe weißlich und mit braunen Flecken und Tupfern gesprenkelt.[17] Die Bebrütung der Eier übernimmt ausschließlich das Weibchen, während das Männchen in dieser Zeit für die Versorgung mit Nahrung zuständig ist, sich dem Nest aber nie auf mehr als etwa 10 bis 20 m nähert. Mögliche Nesträuber attackiert das Weibchen lautstark und aggressiv durch Verfolgungsflüge und Sturzflüge, bis diese sich aus der Umgebung des Nests zurückziehen. Zu den möglichen Fressfeinden von Eiern und Jungvögeln zählen unter anderem Fischertukane (Ramphastos sulfuratus), Sperberweihe (Geranospiza caerulescens) und Klammeraffen (Ateles). Die Inkubationszeit des Geleges beträgt circa 42 bis 44 Tage. Unmittelbar nach dem Schlüpfen sind die jungen Doppelzahnweihe von weichen weißen Daunen bedeckt und zunächst noch hilflos und inaktiv. Erst nach etwa einer Woche beginnen sie, insgesamt aktiver zu werden und bei der Mutter um Nahrung zu betteln. Besonders während der kühleren Stunden des Tages und bei starken Regenfällen werden die Nestlinge vom weiblichen Altvogel gehudert, bei heißen Temperaturen schirmt sie die Jungen hingegen mit ausgebreiteten Flügeln vor der direkten Sonneneinstrahlung ab. Mit dem Fortschreiten der Nestlingsphase verlässt das Weibchen das Nest für immer längere Zeiträume und beginnt nach und nach damit, wieder selbstständige Jagdversuche zu unternehmen. Bis zum endgültigen Flüggewerden der Jungvögel vergehen im Schnitt 27 bis 37 Tage, wobei sie oft schon einige Tage vorher direkt außerhalb des Nests bei ersten Flugübungen beobachtet werden können. Nach dem Verlassen des Nests verbleiben die Nachkommen noch für mehr als einen weiteren Monat in der unmittelbaren Umgebung des Nistplatzes und werden dort weiterhin von den Eltern gefüttert. Erst im Anschluss beginnen sie damit, sich langsam aus der Umgebung zu entfernen, bis sie schließlich völlig unabhängig werden und das Territorium der Altvögel nach einigen Wochen dauerhaft verlassen.[18]
Lautäußerungen
Obwohl diverse Beschreibungen von Rufen und Gesängen der Art existieren, gilt diese außerhalb der Brutzeit als eher leise und wenig ruffreudig.[3] Am häufigsten gehört wird ein dünnes, hochfrequentes cheee-weet, das oft hintereinander wiederholt wird und an den Ruf eines Tyrannen erinnern soll. Diese Lautäußerung scheint primär als Kontaktruf zwischen Paaren, aber auch als Bettelruf brütender Weibchen vor der Nahrungsübergabe zu dienen. Bei der Verteidigung des Nistplatzes kommt darüber hinaus eine lautere, schärfere Version dieses Rufs zur Anwendung. Männchen kündigen ihre Ankunft am Nest mit einer Reihe zirpender Laute an, während Weibchen in der gleichen Situation ein kurzes cheeep ausstoßen. Des Weiteren sind von verschiedenen Forschern ein lispelndes tsiip-tsiip sowie ein schnelles tsup-sup-sup-sup dokumentiert worden, deren genaue Funktion bislang noch unklar ist. Nestlinge betteln mit einer höheren, weniger klaren Variante des typischen Kontaktrufs erwachsener Vögel bei den Adulten um Nahrung.[15]
Verbreitung und Gefährdung
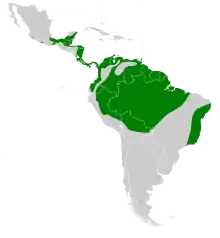
Der Doppelzahnweih ist eine rein neotropische Art mit einem sehr großen Verbreitungsgebiet, dessen Kern sich im Flachland des Amazonasbeckens befindet. In Höhenlagen über 1200 m wird die Art nur selten und lokal begrenzt gesichtet, konnte jedoch in Ecuador auch schon auf circa 2100 m Höhe nachgewiesen werden.[4] Der südamerikanische Teil des Verbreitungsgebiets umfasst den Nordwesten Brasiliens, den Norden Boliviens, den Osten Perus und die Guyanas. Darüber hinaus werden alle tieferliegenden Regionen Venezuelas, Kolumbiens und Ecuadors besiedelt. Des Weiteren sind Nachweise aus den noch vorhandenen Reliktbeständen tropischen Regenwalds an der brasilianischen Atlantikküste bekannt. Über den Isthmus von Panama setzt sich das Verbreitungsgebiet in einem mehr oder weniger breiten Streifen entlang der Karibikküste Mittelamerikas Richtung Norden fort, bis schließlich der Süden Mexikos erreicht wird.[3] Auf Grund seiner Abhängigkeit von alten, unberührten Wäldern für die Fortpflanzung dürfte die zunehmende Entwaldung der Region unweigerlich zu einem Bestandsrückgang des Doppelzahnweihs führen. Zurzeit stuft die IUCN die Art dennoch auf der niedrigsten Gefährdungsstufe least concern („nicht gefährdet“) ein, was vor allem mit dem noch immer sehr großen Verbreitungsgebiet begründet wird.[19] Eine Studie aus Französisch-Guayana ergab eine geschätzte Populationsdichte von 15 Exemplaren je 100 km² zur Besiedelung geeignete Fläche.[3] Niedrigste Schätzungen des globalen Bestandes durch die IUCN liegen bei 500.000 adulten Individuen, der allgemeine Populationstrend ist jedoch abnehmend.[19] Die Art wird in Anhang II des Washingtoner Artenschutzübereinkommens gelistet.[4]
Systematik
Äußere Systematik
Die Erstbeschreibung des Doppelzahnweihs stammt aus dem Jahr 1790 und geht auf den britischen Ornithologen John Latham zurück, der die neue Art anhand eines Typusexemplars aus Cayenne in der damaligen Kolonie Französisch-Guayana beschrieb. Als wissenschaftliche Bezeichnung vergab Latham zunächst den Namen Falco bidentatus, womit er die Art, wie zu dieser Zeit bei vielen neu beschriebenen Greifvögeln üblich, in die Gattung der Falken stellte. Das Artepitheton bidentatus setzt sich dabei aus der lateinischen Vorsilbe bi- für „zwei“ und dem Begriff dentatus für „gezahnt“ zusammen. 1824 beschrieb Nicholas Aylward Vigors die neue Gattung Harpagus mit dem Doppelzahnweih als Typusart. Als Grund dafür benannte er die morphologischen Eigenschaften der Art, die eher an einen Habicht oder Sperber als an einen Falken denken lassen. Die Einordnung in eine neue Gattung begründete Vigors vor allem mit dem Vorhandensein der beiden Vorsprünge am Schnabel, die bei Accipiter-Arten nicht vorkommen.[4] Gemeinsam mit diesen steht Harpagus auch heute noch in der Familie der Habichtartigen (Accipitridae), gehört dort allerdings zur Unterfamilie der Milane (Milvinae). Als wichtigstes gemeinsames Merkmal dieser weit verbreiteten Gruppe gelten miteinander verwachsene Phalangen des zweiten und dritten Zehs ihrer Füße. Ob die Milvinae jedoch tatsächlich eine monophyletische Gruppe formen, ist nicht abschließend geklärt.[20] Als einzige weitere Art der Gattung und damit als nächster Verwandter des Doppelzahnweihs gilt der Braunschenkelweih (H. diodon). Phylogenetische Analysen deuten auf eine Trennung dieser beider Arten erst vor erdgeschichtlich kurzer Zeit zu Beginn des Pleistozäns hin.[21]
Innere Systematik

Innerhalb der Art werden derzeit zwei Unterarten als gültig angesehen. Neben der südamerikanischen Nominatform H. b. bidentatus existiert noch die vornehmlich in Mittelamerika verbreitete Unterart H. b. fasciatus, die von dem amerikanischen Amateurornithologen George Newbold Lawrence ursprünglich als eigenständige Art innerhalb der Gattung Harpagus beschrieben worden war. Die Grenze der Verbreitungsgebiete der beiden Formen verläuft durch Ecuador und Kolumbien.[1]
- H. b. bidentatus (Latham, 1790) – Die Nominatform kommt im gesamten südamerikanischen Teil des Verbreitungsgebiets bis nach Ost-Kolumbien und Ost-Ecuador vor.[3]
- H. b. fasciatus Lawrence, 1869 – Verbreitet von den westlichen Regionen Kolumbiens und Ecuadors über Mittelamerika bis in den Süden Mexikos, etwa auf Höhe der Bundesstaaten Jalisco und Süd-Veracruz. Vertreter dieser Unterart zeigen eine deutlich ausgeprägtere Sperberung im Brust- und Bauchbereich. Zudem findet sich eine rötliche Grundfärbung des Gefieders bei vielen Exemplaren nur an den Flanken und den Schultern. Die Brust und vor allem der Bauch sind hingegen eher weißlich bis cremefarben gefärbt.[3]
Literatur
- Mark D. Schulze, José L. Cordóva, Nathaniel E. Seavy, David F. Whitacre: Neotropical Birds of Prey: Biology and Ecology of a Forest Raptor Community. Hrsg.: David F. Whitacre. Cornell University Press, Ithaka/London 2012, ISBN 978-0-8014-4079-3, S. 68–81.
Weblinks
- Aufnahmen von Rufen und Gesängen bei xeno-canto.org
Einzelnachweise
- Rostbrust-Zahnhabicht (Harpagus bidentatus) bei Avibase; abgerufen am 2021-07-28.
- James Ferguson-Lees, David A. Christie: Raptors of the World. Christopher Helm, London 2001, ISBN 0-7136-8026-1, S. 106.
- James Ferguson-Lees, David A. Christie: Raptors of the World. Christopher Helm, London 2001, ISBN 0-7136-8026-1, S. 366–367.
- Richard O. Bierregaard, Jeffrey S. Marks, Guy M. Kirwan: Double-toothed Kite (Harpagus bidentatus). In: Birds of the World. 2020, abgerufen am 27. Juli 2021 (englisch).
- Schulze et al., Neotropical Birds of Prey, S. 73
- Steve N. G. Howell, Barbara A. Dowell, Douglas A. James, Robert A. Behrstock, Chandler S. Robbins: New and noteworthy bird records from Belize. In: Bulletin of the British Ornithologists' Club. Band 112, Nr. 4, 1992, S. 235–244.
- Julio A. B. Monsalvo: Geographical variation and current knowledge on breeding patterns of Neotropical accipitrid raptors. Hrsg.: Universidade de Brasília. 2018.
- Schulze et al., Neotropical Birds of Prey, S. 78
- Steve N. G. Howell, Ian Lewington, Will Russell: Rare Birds of North America. Princeton University Press, Princeton/Oxford 2014, ISBN 978-0-691-11796-6, S. 230.
- Bev Hansen, Andrew W. Kratter: First Florida record of Double-toothed Kite (Harpagus bidentatus). In: Florida Field Naturalist. Band 47, Nr. 3, 2019, S. 99–104.
- Schulze et al., Neotropical Birds of Prey, S. 69–72
- Aaron J. Baker, David F. Whitacre, Oscar A. Aguirre-Barrera, Juventino López Ávila, Clayton M. White: Observation of a Double-toothed Kite (Harpagus bidentatus) hawking bats. In: Journal of Raptor Research. Band 33, Nr. 4, 1999, S. 343–344.
- Roy Fontaine: Observations on the Foraging Association of Double-Toothed Kites and White-Faced Capuchin Monkeys. In: The Auk. Band 97, Nr. 1, 1980, S. 94–98, doi:10.1093/auk/97.1.94.
- Schulze et al., Neotropical Birds of Prey, S. 72
- Schulze et al., Neotropical Birds of Prey, S. 75
- Schulze et al., Neotropical Birds of Prey, S. 73–75
- Robert M. Laughlin: A Nesting of the Double-Toothed Kite in Panama. In: The Condor. Band 54, Nr. 3, 1952, S. 137–139, doi:10.2307/1365063.
- Schulze et al., Neotropical Birds of Prey, S. 75–78
- Harpagus bidentatus in der Roten Liste gefährdeter Arten der IUCN 2020.2. Eingestellt von: BirdLife International, 2020. Abgerufen am 28. Juli 2021.
- Heather R. L. Lerner, David P. Mindell: Phylogeny of eagles, Old World vultures, and other Accipitridae based on nuclear and mitochondrial DNA. In: Molecular Phylogenetics and Evolution. Band 37, Nr. 2, 2005, S. 327–346, doi:10.1016/j.ympev.2005.04.010.
- David P. Mindell, Jérôme Fuchs, Jeff A. Johnson: Phylogeny, Taxonomy, and Geographic Diversity of Diurnal Raptors: Falconiformes, Accipitriformes, and Cathartiformes. In: J. Sarasola, J. Grande, J. Negro (Hrsg.): Birds of Prey. Springer, 2018, ISBN 978-3-319-73744-7, S. 3–32, doi:10.1007/978-3-319-73745-4_1.