Curacin A
Curacin A ist ein aus dem Cyanobakterium Lyngbya majuscula isoliertes Naturprodukt.[2][3] Curacin A gehört mit Jamaicamid, Mupirocin und Pederin zu einer Familie von Naturstoffen, die ein terminales Alken aufweisen. Darüber hinaus enthält Curacin A einen Thiazolinring und eine Cyclopropyleinheit, die für die biologische Aktivität der Verbindung wesentlich ist.[2][3][4] Curacin A wurde als potente, wachstumshemmende, zytotoxische Verbindung mit bemerkenswerter Antikrebsaktivität für verschiedene Krebslinien charakterisiert, darunter Nieren-, Dickdarm- und Brustkrebs.[2][4] Es wurde gezeigt, dass Curacin A mit Colchicin-Bindungsstellen auf Tubulin interagiert, was die Mikrotubulus-Polymerisation hemmt, ein wesentlicher Prozess für die Zellteilung und das Zellwachstum.[2][5]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
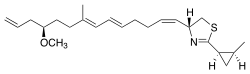 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Curacin A | ||||||||||||
| Summenformel | C23H35NOS | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 373,60 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Isomere
Curacin B und C sind Isomere des Curacin A. Bei Curacin D handelt es sich vermutlich um Demethylcuracin.[3]
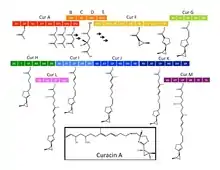
Biosynthese
Die Biosynthese von Curacin A ist seit 2009 durch Gu et al. vollständig beschrieben. Die Synthese beruht auf einem Gencluster von ungefähr 64 kb, die NRPS und mehrere Polyketidsynthasen exprimieren (PKSs).[3]
Rechtslage
Curacin A und seine Isomere sind seit 1998 patentiert.[3]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Zunxue Chang, Namthip Sitachitta, James V. Rossi, Mary Ann Roberts, Patricia M. Flatt, Junyong Jia, David H. Sherman, William H. Gerwick: Biosynthetic Pathway and Gene Cluster Analysis of Curacin A, an Antitubulin Natural Product from the Tropical Marine Cyanobacterium. In: Journal of Natural Products. 67, Nr. 8, August 2004, S. 1356–1367. doi:10.1021/np0499261. PMID 15332855.
- Jean-Michel Kornprobst: Encyclopedia of Marine Natural Products. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2014, ISBN 978-3-527-33585-5, doi:10.1002/9783527335855 (wiley.com [abgerufen am 11. Juni 2019]).
- Liangcai Gu, Todd W. Geders, Bo Wang, William H. Gerwick, Kristina Håkansson, Janet L. Smith, David H. Sherman: GNAT-Like Strategy for Polyketide Chain Initiation. In: Science. 318, 2007, S. 970–974. doi:10.1126/science.1148790. PMID 17991863.
- A. V. Blokhin, H. D. Yoo, R. S. Geralds, D. G. Nagle, W. H. Gerwick, E. Hamel: Characterization of the interaction of the marine cyanobacterial natural product curacin A with the colchicine site of tubulin and initial structure-activity studies with analogues. In: Molecular Pharmacology. 48, 1995, S. 523–531. PMID 7565634.