Corey-Nicolaou-Makrolactonisierung
Die Corey-Nicolaou-Makrolactonisierung (auch bekannt als Corey-Nicolaou-Doppelaktivierung) ist eine Namensreaktion der Organischen Chemie, die von Elias James Corey und Kyriacos Costa Nicolaou 1974 veröffentlicht wurde. Diese Synthese dient der Herstellung makrocyclischer Lactone (Makrolide).[1][2]
Übersichtsreaktion
Mit Hilfe der Corey-Nicolaou-Makrolactonisierung lässt sich aus einer ω-Hydroxycarbonsäure und unter Verwendung von 2,2'-Dipyridyldisulfid und Triphenylphosphan (PPh3) ein Makrolid herstellen.[2]

Allgemein
Die Corey-Nicolaou-Makrolactonisierung ermöglicht es, mittelgroße bis sehr große Lactone zu synthetisieren. Mit Hilfe dieser Reaktion gelang bisher die Herstellung von 7- bis hin zu 48-gliedrigen Ringen. Als Lösungsmittel werden Xylole, Toluol oder Benzol genutzt. Die Reaktion findet zum Großteil bei Raumtemperatur bzw. bei 25 °C und über einen längeren Zeitraum statt. Wegen der milden Reaktionsbedingungen eignet sich diese Reaktion auch für polyfunktionelle Stoffe.[2][3]
Reaktionsmechanismus
Der Reaktionsmechanismus der Corey-Nicolaou-Makrolactonisierung könnte wie folgt aussehen.[1] Im ersten Schritt greift das freie Elektronenpaar des Triphenylphosphan (PPh3) ein Schwefelatom des 2,2'-Dipyridyldisulfid 1 nucleophil an. Die Bindung zwischen den Schwefelatomen des 2,2'-Dipyridyldisulfid bricht. Es entstehen das Anion 2 und das Kation 3.

Im nächsten Schritt wird die Carboxygruppe der ω-Hydroxycarbonsäure 4 durch das freie Elektronenpaar am Stickstoff von Anion 2 deprotoniert. Dadurch bildet sich 2-Pyridinthion. Die Carboxylatgruppe greift die Phosphoniumgruppe des Kation 3 an. Es entstehen das Kation 5 und das Anion 6.
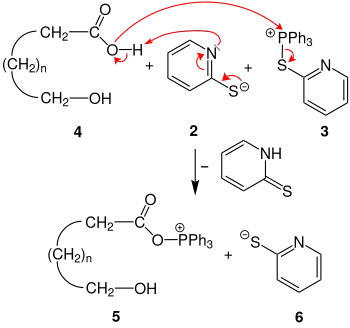
Das Anion 6 greift nucleophil die Acylgruppe des Kations 5 an. Es bildet sich das tetraedische Zwischenprodukt 7. Unter Rückbildung der Acylgruppe zum Thioester 8 wird Triphenylphosphanoxid abgespalten. Das freie Elektronenpaar des Stickstoffs deprotoniert die ω-Hydroxygruppe. Es entsteht das Zwitterion 9.

Durch einen intramolekularen nucleophilen Angriff der Acylgruppe durch das Alkoholatanion und gleichzeitiger Deprotonierung des Pyridiniumrests entsteht das Intermediat 10. Unter Rückbildung der Acylgruppe und Abspaltung von 2-Pyridinthion entsteht das Makrolid 11.[1]

Anwendung
Die Corey-Nicolaou-Makrolactonisierung gehört zu den effizientesten Reaktionen ihrer Art. Die Ausbeute variiert durch die zu erzielende Ringgröße. Bis auf einige Ausnahmen lassen sich bis zu einer Ringgröße von 16 Gliedern 60–80 % des Produkts isolieren. Ausnahmen lassen sich hierbei auf ungünstige Ringspannungen zurückführen. Sie eignet sich vor allem für die Synthese von Naturstoffen und findet so in vielen Totalsynthesen Anwendung.[2][4][5]
Einzelnachweise
- Jie Jack Li: Name reactions. A collection of detailed reaction mechanisms. 3. Auflage. Springer-Verlag, Berlin 2006, ISBN 978-3-540-30030-4, S. 164–165, doi:10.1007/3-540-30031-7.
- E. J. Corey, Kyriacos C. Nicolaou: An Efficient and Mild Lactonization Method for the Synthesis of Macrolides. In: Journal of the American Chemical Society. Band 96, Nr. 17, 1974, S. 5614–5616, doi:10.1021/ja00824a073.
- E.J.Corey, Daniel J.Brunelle: New reagents for the conversion of hydroxy acids to macrolactones by the double activation method. In: Tetrahedron. Band 17, Nr. 38, 1976, S. 3409–3412, doi:10.1016/S0040-4039(00)93057-0.
- K. C. Nicolaou: Synthesis of macrolides. In: Tetrahedron. Band 33, Nr. 7, 1977, S. 683–710, doi:10.1016/0040-4020(77)80180-4.
- A. Parenty, X. Moreau, J.-M. Campagne: Macrolactonizations in the Total Synthesis of Natural Products. In: Chemical Reviews. Band 106, Nr. 3, 2006, S. 911–939, doi:10.1021/cr0301402.