Choanocyt
Choanocyten (auch Choanozyten, Kragengeißelzellen) sind ein Zelltyp, der bei Schwämmen (Porifera) vorkommt. Die Choanozyten bilden in den Schwämmen eine Deckzellschicht, die Choanoderm genannt wird. Das Choanoderm kleidet den Innenraum der Schwämme aus (Spongocoel, Gastralraum, Geißelkammer).[1] Die Kragengeißelzelle besteht aus einem rundlichen Zellkörper (Soma). An einem Zellpol sitzt eine lange Geißel (Flagellum). Um die Geißel herum steht ein Ring aus Stereovilli. Dies ist der namensgebende Kragen. Zwischen den einzelnen Stereovilli sitzt Schleim. So entsteht ein Schleimsaum (Plasmakragen). Durch den Geißelschlag wird ein Wasserstrom erzeugt, der von den Seiten Wasser zuführt. Das Wasser tritt durch den Schleimsaum. Im Wasser schwebende Nahrungspartikel verfangen sich im Schleim. Sie werden anschließend durch Pseudopodien eingefangen[2] und mittels Endozytose von der Kragengeißelzelle aufgenommen.[3]
_(14763631314).jpg.webp)
Bei Schwämmen entsteht durch den gemeinsamen Geißelschlag aller Choanozyten des Choanoderms ein kollektiver Wasserstrom. Das Wasser strömt von den Seiten (durch Porocyten) in das Spongocoel, an den Kragengeißelzellen des Choanoderms vorbei und wieder durch die Ausstromöffnung (Osculum) hinaus. Dabei entnehmen die Choanozyten dem Wasser viele Partikel. Partikelreiches Wasser strömt in den Schwamm hinein und partikelarmes Wasser hinaus. Die endozytierenden Choanozyten übernehmen einerseits selbst den Verdau des aufgenommenen Materials. Sie geben aber andererseits auch Phagosomen weiter an Amoebocyten. Die Choanozyten helfen außerdem bei der Fortpflanzung. Ihr Wasserstrom sorgt dafür, dass Spermien durch die Ausstromöffnung hinaus gestoßen werden. Der Strom gewährleistet gleichzeitig, dass fremde Spermien durch die Porozyten hinein gesaugt werden, um die Eizellen des innen gelegenen Mesohyls zu befruchten.
Kragengeißelzellen finden sich nicht nur in Schwämmen. Auffällig ist vor allem ihr Vorkommen bei den Kragengeißeltierchen (Choanoflagellata). Das sind Mikroorganismen, die entweder als einzelne Kragengeißelzellen leben oder kleine Zellkolonien aus Kragengeißelzellen bilden. Die Ähnlichkeit zwischen den Zellen der Choanoflagellata und den Schwamm-Choanozyten ist frappierend.[4] Sie reicht bis in feinstrukturelle Übereinstimmungen hinein.[5]
Vorkommen
Typische und klar erkennbare Kragengeißelzellen kommen bei Kragengeißeltierchen (Choanoflagellata) und Schwämmen (Porifera) vor. Es finden sich zudem bestimmte Zelltypen bei vielen anderen Tieren, die ebenfalls größere Ähnlichkeiten zu Kragengeißelzellen aufweisen. Sie ähneln aber weniger den Kragengeißelzellen adulter Schwämme, sondern eher deren unfertigen Zellentwicklungsstadien, wie sie in Schwamm-Embryonen gefunden werden.[6] Solche monociliären Epithelzellen erfüllen häufig Rezeptorfunktionen.[7]
Die heute lebenden Scheibentiere (Placozoa) haben keine Zellen, die gleich auf den ersten Blick wie Kragengeißelzellen aussehen. Stattdessen besitzen sie tönnchenförmige Zylinderzellen in dem hochprismatischen Epithel der ventralen Körperseite. Ganz ähnlich wie die Kragengeißelzellen tragen diese Zylinderzellen eine zentrale Geißel. Im histologischen Dünnschnittpräparat ist zudem zu erkennen, dass die Zellmembran um die Geißel herum Microvilli ausstülpt. Die Zylinderzellen nehmen Nahrungspartikel durch Endocytose auf. Auf der dorsalen Körperseite des Tieres befinden sich ebenfalls monociliäre Zellen. Sie sind jedoch flacher und ohne Microvilli.[8]
Kragengeißelzellähnliche Zellen sind bei verschiedenen Nesseltieren (Cnidaria) aus der Gruppe der Blumentiere (Anthozoa) gefunden worden.[9][10] Auch im Integument von Plattwürmern (Plathelminthes) befinden sich Zellen, die Kragengeißelzellen ähneln. Es handelt sich um einzellige Mechanorezeptoren.[11] Kragengeißelzellähnliche Zellen mit bis zu 12 Flagellen wurden bei einer freischwimmenden Schnurwurm-Larve (Nemertea) ausgemacht.[12] Weiterhin wurden Mechanorezeptoren, die stark an Kragengeißelzellen erinnern, bei Ringelwürmern (Annelida) aus der Gruppe der Wenigborster (Oligochaeta) gefunden.[13] Im Verdauungstrakt eines Stachelhäuters (Echinodermata) aus der Gruppe der Seesterne (Asteroidea) wurden zwei verschiedene Zelltypen bestimmt, die Kragengeißelzellen ähneln.[14] Bei Stachelhäutern dienen monociliäre Zellen als Rezeptor- und Stützzellen.[15]
Evolution
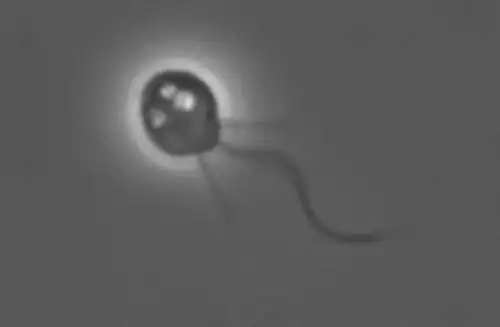
Die Kragengeißelzellen der Kragengeißeltierchen (Choanoflagellata) und Schwämme (Porifera) sind kaum voneinander zu unterscheiden. Deshalb wird davon ausgegangen, dass die Schwämme die ersten mehrzelligen Tiere waren, die sich aus einzelligen, beziehungsweise kolonienbildenden Kragengeißeltierchen entwickelt haben.[16][17][18] Diese Tiere (Metazoa) entstanden im Proterozoikum und waren also Lebewesen, die heutigen Schwämmen stark ähnelten und demzufolge die typischen Kragengeißelzellen besaßen. Aus jener Zeit konnte allerdings bisher kein unumstrittener fossiler Beleg für ihre Anwesenheit geborgen werden. Zwar könnten zum Beispiel Biomarker aus dem Cryogenium auf das Vorhandensein von Schwämmen vor mindestens 635 Millionen Jahren hindeuten,[19] die Stoffe könnten jedoch auch von Algen synthetisiert worden sein.[20][21]
Aus den Schwämmen entwickelten sich die Epitheliozoa, die sich anschließend in die Gruppen der Scheibentiere (Placozoa) und der Gewebetiere (Eumetazoa) spalteten.[22] Die frühesten Fossilien von Gewebetieren könnten heutigen Blumentieren (Anthozoa) geähnelt haben und ein Alter von etwa 590 Millionen Jahren besitzen,[23] aber auch ihre Identität kann bezweifelt werden.[24] Davon abgesehen kommen bei solchen Tieren kragengeißelzellähnliche Zellen noch heute vor. Die ältesten Fossilien von Zweiseitentieren (Bilateria) stammen dann aus dem oberen Ediacarium und sind etwa 555 Millionen Jahre alt.[25]
Viele rezente Tiere besitzen kragengeißelzellähnliche Zellen. Nur bei den Rippenquallen (Ctenophora) und bei einem Zweig der Häutungstiere (Ecdysozoa) wurden sie zur Unkenntlichkeit rückentwickelt.[26] Zusammengenommen scheint es sehr wahrscheinlich, dass der letzte gemeinsame Vorfahre aller Tiere zu den Schwämmen zählte und Choanozyten besaß als ein Erbe seiner Kragengeißeltierchen-Vorfahren. Solche Choanozyten sind heute bei adulten Schwämmen erhalten. Der letzte gemeinsame Vorfahre aller Epitheliozoa besaß Choanozyten, die bestimmten Zellentwicklungsstadien in heutigen Schwamm-Embryonen ähnelten. Nachdem sich Scheibentiere und Gewebetiere voneinander getrennt hatten, wandelten die Scheibentiere den Zelltyp weiter ab, so dass beim einzigen heute lebenden Scheibentier (Trichoplax adhaerens) keine stark kragengeißelzellähnlichen Zellen mehr gefunden werden. Der letzte gemeinsame Vorfahre aller Gewebetiere besaß die kragengeißelzellähnlichen Zellen aber noch. Auch der letzte gemeinsame Vorfahre aller Zweiseitentiere verfügte über kragengeißelzellähnlichen Zellen. Die Zellen evolvierten bei verschiedenen Gewebetierstämmen in unterschiedliche Richtungen und veränderten mehr oder weniger umfangreich ihre Gestalt. Zweimal scheinen sie vollständig verloren gegangen zu sein.
Einzelnachweise
- Félix Dujardin: Histoire naturelle des zoophytes. Librairie encyclopédique de Roret, Paris, 1841, S. 306.
- Sally P. Leys, Dafne I. Eerkes-Medrano: Feeding in a Calcareous Sponge: Particle Uptake by Pseudopodia. In: Biology Bulletin. Band 211, 2006, S. 157.
- Neil A. Campbell, Jane B. Reece: Biologie. Heidelberg/Berlin 2006, S. 769.
- ">Henry James-Clark: On the Spongiae Ciliatae as Infusoria Flagellata. In: Memoirs read before the Boston Society of Natural History. Band 1, 1867, S. 305–340.
- Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, 2015, S. 1.
- Manuel Maldonadoa: Choanoflagellates, choanocytes, and animal multicellularity. In: Invertebrate Biology. Band 123, 2004, S. 1.
- W. Westheide, R. Rieger (Hrsg.): Spezielle Zoologie. Teil 1: Einzeller und Wirbellose Tiere. München, 2007, S. 125–126.
- V. Storch, U. Welsch: Systematische Zoologie. Spektrum Akademischer Verlag, Heidelberg/ Berlin 2004, S. 37–38.
- K. M. Lyons: Collar cells in planula and adult tentacle ectoderm of the solitary coral Balanophyllia regia (anthozoa eupsammiidae). In: Cell and Tissue Research. Band 145, Nr. 1, 1973, S. 57–74.
- W. M. Goldberg, G. T. Taylor: Cellular structure and ultrastructure of the black coral Antipathes aperta: 2. The gastrodermis and its collar cells. In: Journal of Morphology. Band 202, Nr. 2, 2005, S. 255–269.
- U. Ehlers, B. Ehlers: Monociliary receptors in interstitial Proseriata and Neorhabdocoela (Turbellaria Neoophora). In: Zoomorphology. Band 86, Nr. 3, 1977, S. 197–222.
- C.-E. Cantell, Å. Franzén, T. Sensenbaugh: Ultrastructure of multiciliated collar cells in the pilidium larva of Lineus bilineatus (Nemertini). In: Zoomorphology. Band 101, Nr. 1, 1982, S. 1–15.
- K. Moritz, V. Storch: Elektronenmikroskopische Untersuchung eines Mechanorezeptors von Evertebraten (Priapuliden, Oligochaeten). In: Cell and Tissue Research. Band 117, Nr. 2, 2004, S. 226–234.
- A. Martinez, J. Lopez, A. C. Villaro, D. P. Sesma: Choanocyte-like cells in the digestive system of the starfish Marthasterias glacialis (Echinodermata). In: Journal of Morphology. Band 208, Nr. 2, 2005, S. 215–225.
- W. Westheide, R. Rieger (Hrsg.): Spezielle Zoologie. Teil 1: Einzeller und Wirbellose Tiere. München 2007, S. 807.
- Henry James-Clark: On the Spongiae Ciliatae as Infusoria Flagellata. In: Memoirs read before the Boston Society of Natural History. Band 1, 1867, S. 305–340.
- H. Philippe, R. Derelle, P. Lopez, K. Pick, C. Borchiellini, N. Boury-Esnault, J. Vacelet, E. Renard, E. Houliston, E. Quéinnec, C. Da Silva, P. Wincker, H. Le Guyader, S. Leys, D. J. Jackson, F. Schreiber, D. Erpenbeck, G. Morgenstern, Wörheide, M. Manuel: Phylogenomics Revives Traditional Views on Deep Animal Relationships. In: Current Biology. Band 19, 2009, S. 706.
- Martin Dohrmann, Gert Wörheide: Dating early animal evolution using phylogenomic data. In: Scientific Reports. Band 7, 2017, S. 4.
- J. Alex Zumberge, Gordon D. Love, Paco Cárdenas, Erik A. Sperling, Sunithi Gunasekera, Megan Rohrssen, Emmanuelle Grosjean, John P. Grotzinger, Roger E. Summons: Demosponge steroid biomarker 26-methylstigmastane provides evidence for Neoproterozoic animals. In: Nature Ecology & Evolution. Band 2, 2018, S. 1709.
- Ilya Bobrovskiy, Janet M. Hope, Benjamin J. Nettersheim, John K. Volkman, Christian Hallmann, Jochen J. Brocks: Algal origin of sponge sterane biomarkers negates the oldest evidence for animals in the rock record. In: Nature Ecology & Evolution. Brief Communications, 23. November 2020, doi:10.1038/s41559-020-01334-7.
- Lennart M. van Maldegem, Benjamin J. Nettersheim, Arne Leider, Jochen J. Brocks, Pierre Adam, Philippe Schaeffer, Christian Hallmann: Geological alteration of Precambrian steroids mimics early animal signatures. In: Nature Ecology & Evolution. Brief Communications, 23. November 2020, doi:10.1038/s41559-020-01336-5.
- Martin Dohrmann, Gert Wörheide: Dating early animal evolution using phylogenomic data. In: Scientific Reports. Band 7, 2017, S. 4.
- S. Xiao, X. Yuan, A. H. Knoll: Eumetazoan fossils in terminal Proterozoic phosphorites? In: PNAS. Band 97, 2000, S. 13684–13689.
- John A. Cunningham, Kelly Vargas, Liu Pengju, Veneta Belivanova, Federica Marone, Carlos Martínez-Pérez, Manuel Guizar-Sicairos, Mirko Holler, Stefan Bengtson, Philip C. J. Donoghue: Critical appraisal of tubular putative metazoans from the Ediacaran Weng’an Dushantuo biota. In: Proceedings of the Royal Society of London · Series B. Band 282. 2015, doi:10.1098/rspb.2015.1169, S. 7–8.
- Ilya Bobrovskiy, Janet M. Hope, Andrey Ivantsov, Benjamin J. Nettersheim, Christian Hallmann, Jochen J. Brocks: Ancient steroids establish the Ediacaran fossil Dickinsonia as one of the earliest animals. In: Science, Band 361, 2018, doi:10.1126/science.aat7228, S. 1248.
- Thibaut Brunet, Nicole King: Premetazoan genome evolution and the regulation of cell differentiation in the choanoflagellate Salpingoeca rosetta. In: Developmental Cell. Band 43, 2017, S. 125.