Bovine Leukozytenadhäsionsdefizienz
Die Bovine Leukozytenadhäsionsdefizienz (BLAD) (englisch Bovine Leucocyte Adhesion Deficiency, abgekürzt BLAD) ist eine autosomal rezessiv vererbte Krankheit bei Rindern der Rasse Holstein Friesian. Betroffene Tiere weisen eine gestörte Funktion der weißen Blutzellen auf, wodurch sie anfällig für Infektionen sind. Die Erkrankung wurde im Jahr 1983 zum ersten Mal beschrieben.[1] Die genetische Ursache der Erkrankung, ein Einzelnukleotid-Polymorphismus in einem Leukozytenadhäsionsmolekül, konnte erst neun Jahre später aufgedeckt werden.[2]
Ursache
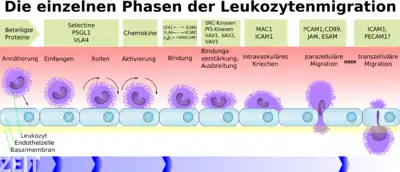
Ursache für die Erkrankung ist ein nicht-synonymer Einzelnukleotid-Polymorphismus (SNP, engl. Single Nucleotide Polymorphism) an Position 383 des CD18-Gens.[3] Der Austausch eines Adenins gegen ein Guanin bewirkt die Substitution der Aminosäure Asparaginsäure gegen die Aminosäure Glycin an Position 128 im Adhäsionsmolekül CD18. Bei homozygoten Trägern kommt es zu einer beeinträchtigten Expression des β2-Integrins des Leukozytenadhäsionsmoleküls bei Neutrophilen.
Die neutrophilen Granulozyten weisen dadurch eine unterschiedlich stark ausgeprägte Störung der Adhäsionsfähigkeit auf. Dadurch können sie nicht mehr stabil am Endothel der Gefäßwand anhaften und damit nicht mehr durch das Endothel migrieren.
Da damit die Rekrutierung der Neutrophilen zu entzündlichen Prozessen gestört ist, ist die immunologische Abwehr betroffener Tiere deutlich herabgesetzt.[4] Entsprechend leiden die Tiere unter rezidivierenden Infektionen und einer gestörten Wundheilung.
Auch beim Menschen gibt es eine ähnliche Erkrankung, die hier als Leukozyten-Adhäsionsdefizienz Typ I (LAD I) bezeichnet wird.[5] Die bei Hunden auftretende Erkrankung Canine Leukozyten-Adhesionsdefizienz (CLAD) wird als Modellerkrankung verwendet, um Ursachen und Therapiemöglichkeiten für betroffenen Menschen zu erforschen.[6]
Symptome
Die Symptome treten innerhalb der ersten Lebensmonate klinisch in Erscheinung.[7] Betroffene Kälber zeigen deutlich reduziertes Wachstum und leiden häufig unter rezidivierenden bakteriellen Infektionen und weisen eine verzögerte Wundheilung auf. Im Maul, vor allem am Zahnfleisch im Bereich der Schneidezähne, bilden sich schwere Schleimhauterosionen und -ulzerationen sowie starke Entzündungen des Zahnhalteapparates (Parodontitis) bis hin zu Zahnverlust und Osteomyelitis der Kieferknochen. Häufig treten chronische Lungenentzündungen oder Durchfälle auf.[8] Labordiagnostisch ist eine persistierende Erhöhung der Zahl der neutrophilen Granulozyten (Neutrophilie) im Blut nachweisbar.
Trotz symptomatischer Therapie verläuft die Erkrankung innerhalb der ersten beiden Lebensjahre tödlich, wobei die Tiere meist an Komplikationen der Atemwegsinfektionen oder der Durchfälle versterben.
Vererbungsgang
Die Bovine Leukozytenadhäsionsdefizienz unterliegt einem autosomal-rezessiven Erbgang. Nur homozygote Tiere erkranken an der tödlich verlaufenden Erkrankung, während heterozygote Tiere weder Symptome noch eine Leistungsminderung zeigen. Nachdem der Gendefekt als Ursache für die Erkrankung identifiziert wurde, gelang es, diesen durch mehrere Generationen von Zuchtbullen bis zu dem Bullen Osborndale Ivanhoe (1952–1963) zurückzuverfolgen. Dies war möglich, da es von den Bullen jeweils noch konserviertes Gefriersperma gab, das auf den Gendefekt hin untersucht werden konnte.[9] Osborndale Ivanhoe gilt als der erste Bulle, der durch den Einsatz der künstlichen Besamung verbunden mit der Möglichkeit, Sperma für einen langen Zeitraum in flüssigem Stickstoff zu konservieren, internationale Bedeutung für die Holstein-Friesian-Zucht erlangte. Viele seiner männlichen Nachkommen waren herausragende Zuchtbullen, die international intensiv in der Holstein-Zucht eingesetzt wurden. Vor allem sein Sohn Penstate Ivanhoe Star und der Enkel Carlin-M Ivanhoe Bell, die in den 1980er- und 1990er-Jahren als international stark begehrte Besamungsbullen eingesetzt wurden, haben zur massiven Verbreitung des Gendefektes in der Holstein-Friesian-Population beigetragen.[10]
Zwei Jahrzehnte nach Osborndale Ivanhoes Tod war durch den massiven weltweiten Einsatz seiner Nachkommen ein hoher Grad von Inzucht in der Holstein-Friesian-Zucht erreicht, wodurch zunehmend homozygote Träger auftraten. Zum Zeitpunkt der Entdeckung des Erbgangs waren in den USA 15 % der Bullen und 6 % der Zuchtkühe Träger der Mutation.[11]
Weltweit wurden Träger des BLAD-Allels unter Holstein-Rindern in verschiedenen Ländern auf allen fünf Kontinenten identifiziert.[12] Die Prävalenz unter den zur Zucht eingesetzten Zuchtbullen war dabei unterschiedlich.
Maßnahmen zur Eradikation
Nach der Aufdeckung des Erbgangs wurden durch die Zuchtverbände züchterische Maßnahmen ergriffen, um die Zucht homozygoter Träger zu vermeiden und BLAD mittelfristig aus der Holstein-Population zu eliminieren. Für die Identifikation der heterozygoten BLAD-Träger wurde Anfang der 1990er-Jahre ein genetischer Test entwickelt.[13] In vielen Ländern wurden alle Bullen vor dem Einsatz in der künstlichen Besamung mit einem genetischen Test daraufhin untersucht, ob sie Träger von BLAD waren.[14] Träger der BLAD-Mutation wurden von der Zucht ausgeschlossen. Bereits zugelassene Bullen wurden in den Bullenkatalogen mit BL, Nicht-Träger mit FL gekennzeichnet, so dass vor einer Anpaarung das Risiko eines homozygoten Kalbes abgeschätzt werden konnte.[15]
Auch wenn es durch diese Maßnahmen gelungen ist, die Prävalenz des BLAD-Allels unter Holstein-Zuchtieren deutlich zu reduzieren, so konnte es bisher nicht vollständig eliminiert werden.[16]
Siehe auch
Einzelnachweise
- W.A. Hagemoser u. a.: Granulocytopathy in a heifer. In: Jornal of the American Veterinary Medical Association. 183, 1093–1094, 1983.
- D. E. Shuster: Identification and prevalence of a genetic defect that causes leukocyte adhesion deficiency in Holstein cattle. In: Proc. Natl. Acad. Sci. USA. Vol. 89, Oktober 1992, S. 9225–9229.
- D. E. Shuster: Identification and prevalence of a genetic defect that causes leukocyte adhesion deficiency in Holstein cattle. In; Proc. Natl. Acad. Sci. USA, Vol. 89, Oktober 1992, S. 9225–9229.
- T. W. Olchowy: Bovine leukocyte adhesion deficiency: in vitro assessment of neutrophil function and leukocyte integrin expression. In: Can J Vet Res. 58(2), April 1994, S. 127–133.
- A. A. Schäffer, C. Klein: Animal Models of Human Granulocyte Diseases. In: Hematol Oncol Clin North Am. 27(1), Februar 2013, S. 129–148.
- Creevy u. a.: Canine leukocyte adhesion deficiency colony for investigation of novel hematopoietic therapies. In: Vet Immunol Immunopathol. 94(1-2), Juli 2003, S. 11–22.
- A. Treviranus: Klinische Befunde und Abstammung von Kälbern und Jungrindern mit Boviner Leukozyten-Adhäsions-Defizienz BLAD. Dissertation an der TiHo Hannover, 1993.
- M. R. Ackermann: Alimentary and respiratory tract lesions in eight medically fragile Holstein cattle with bovine leukocyte adhesion deficiency (BLAD). In: Vet Pathol. 33(3) Mai 1996, S. 273–281.
- M. E. Kehrli: Molecular definition of the bovine granulocytopathy syndrome: identification of deficiency of the Mac-1 (CDllWCD18) glycoprotein. In: Am J Vet Res. 51 (11) 1990, S. 1826–1836.
- D. E. Shuster: Identification and prevalence of a genetic defect that causes leukocyte adhesion deficiency in Holstein cattle. In: Proc. Natl. Acad. Sci. USA. Vol. 89, Oktober 1992, S. 9225–9229.
- D. E. Shuster: Identification and prevalence of a genetic defect that causes leukocyte adhesion deficiency in Holstein cattle. In: Proc. Natl. Acad. Sci. USA, Vol. 89, Oktober 1992, S. 9225–9229.
- H. Nagahata: Bovine leukocyte adhesion deficiency (BLAD): a review. In: J Vet Med Sci. Dezember 2004, S. 1475–1482.
- M. H. Mirck u. a.: Optimization of the PCR test for the mutation causing bovine leukocyte adhesion deficiency. Cell Mol Biol 41 (5), Juli 1995, S. 695–698.
- D. E. Illie u. a.: Control Strategies for Prevention of Undesirable Traits in Cattle – Review. Animal Science and Biotechnologies, 44(1) 2011, S. 415–419.
- Holstein Foundation: Understanding Genetics and the Sire Summaries. S. 7.
- D. E. Illie u. a.: Control Strategies for Prevention of Undesirable Traits in Cattle – Review. In: Animal Science and Biotechnologies. 44(1) 2011, S. 415–419.