Bis(diethylammonium)tetrachloridocuprat(II)
Bis(diethylammonium)tetrachloridocuprat(II) ist eine chemische Verbindung und gehört zur Gruppe der Cuprate. Es handelt sich um einen thermochromen Stoff.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Strukturformel der beiden Ionen von Bis(diethylammonium)tetrachloridocuprat(II) in der Hochtemperaturvariante | |||||||
| Allgemeines | |||||||
| Name | Bis(diethylammonium)tetrachloridocuprat(II) | ||||||
| Summenformel | C8H24Cl4CuN2 | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 353,65 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt |
77 °C[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Gewinnung und Darstellung
Bis(diethylammonium)tetrachloridocuprat(II) wird durch die Reaktion von Diethylammoniumchlorid mit Kupfer(II)-chlorid in einer alkoholischen Lösung hergestellt.
Eigenschaften
Der grüne Feststoff besteht aus nadelförmigen Kristallen, die hygroskopisch sind. Er ist gut in Ethanol und schlecht in Isopropanol löslich. Ab einer Temperatur von 52 °C findet eine Phasenumwandlung erster Ordnung statt. Das verzerrt quadratisch-planare Cuprat-Ion wandelt sich in die verzerrt tetraedrische Form um, was zur Folge hat, dass sich das Absorptionsmaximum vom roten in den violetten Bereich verschiebt. Der Feststoff ändert die Farbe von Grün zu Gelb.[3][1]
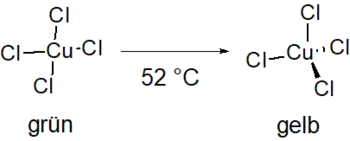
Die quadratisch-planare Struktur des Cuprats wird mithilfe von Wasserstoffbrückenbindungen stabilisiert (). Durch thermische Anregung wird diese Wasserstoffbrückenbindung geschwächt und es kommt zu der beschriebenen Umwandlung. Die Änderung der Stärke der Wasserstoffbrücken kann mithilfe eines Infrarot(IR)-Spektrums nachgewiesen werden, da es im Bereich der N-H-Streckschwingung (ca. 3067 cm−1) zu einer Änderung der Absorptionsbande kommt. Außerdem kann mit einem IR-Spektrum im fernen IR-Bereich gezeigt werden, dass die Koordination der Chloridionen am Cu-Ion sich von quadratisch-planar zu tetraedrisch ändert.[1]
tetrachloridocuprat(II).jpg.webp)
Verwendung
Aufgrund der Instabilität gegenüber Feuchtigkeit und seines spezifischen Temperaturbereichs findet dieser thermochrome Stoff keine technische Anwendung. Zu Lehr- und Übungszwecken ist er jedoch gut einsetzbar, da er unkompliziert herstellbar ist und sich mit gängigen Labormethoden, wie einem IR-Spektrometer oder einem UV/Vis-Spektrometer, untersuchen lässt.
Literatur
- Darrell R. Bloomquist, Mark R. Pressprich, Roger D. Willett: Thermochromism in copper(II) halide salts. 4. Bis(diethylammonium)tetrachlorocuprate(II), structure of the high-temperature phase and physical characterization of its two phases. In: Journal of the American Chemical Society. Band 110, Nr. 22, Oktober 1988, S. 7391–7398, doi:10.1021/ja00230a020.
- Sofiane Bouacida, Rafika Bouchene, Amina Khadri, Ratiba Belhouas, Hocine Merazig: Bis[4-(dimethylamino)pyridinium] tetrachloridocuprate(II). In: Acta Crystallographica Section E: Structure Reports Online. Band 69, Pt 11, 2013, ISSN 1600-5368, S. m610–m611, doi:10.1107/S1600536813028006, PMID 24454040, PMC 3884264 (freier Volltext).
- Christoph Janiak, Hans-Jürgen Meyer, Dietrich Gudat, Philipp Kurz: Riedel Moderne Anorganische Chemie. 5. Auflage. Walter de Gruyter, Berlin / Boston 2018, ISBN 978-3-11-044163-5, S. 427 (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
- Sunhee Choi, James A. Larrabee: Thermochromic tetrachlorocuprate(II). An advanced integrated laboratory experiment. In: Journal of Chemical Education. Nr. 66, September 1989, S. 774–776, doi:10.1021/ed066p774 (wisc.edu).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Michiel J. M. Van Oort: Preparation of a Simple Thermochromic Solid. In: Journal of Chemical Education. Nr. 65, Januar 1988, S. 84, doi:10.1021/ed065p84 (wisc.edu).