Baudisch-Reaktion
Die Baudisch-Reaktion ist eine Namensreaktion der organischen Chemie, welche 1939 erstmals von Oskar Baudisch (1881–1950) veröffentlicht und nach ihm benannt wurde. 1947 wurde die Reaktion von seinem Kollegen Georg Cronheim weiterentwickelt.[1] Die Baudisch-Reaktion ermöglicht die Synthese von ortho-Nitrosophenol.[2]
Übersichtsreaktion
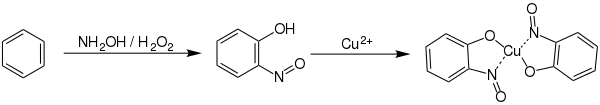
Die Synthese von ortho-Nitrosophenol geschieht in mehreren Reaktionsschritten ausgehend von Benzol, Hydroxylamin und Wasserstoffperoxid in Gegenwart von Kupfersalzen. Das Kupfersalz ist notwendig, damit die Nitrosylverbindung durch Bildung eines Kupferkomplexes stabilisiert und eine weitere Oxidation verhindert wird.[3]
Reaktionsmechanismus
In der Literatur finden sich mehrere einander teilweise widersprechende Vorschläge für einen Reaktionsmechanismus.
Reaktionsmechanismus nach Oskar Baudisch
An ein Benzol-Molekül wird zunächst eine Nitrosogruppe und danach eine Hydroxygruppe durch Oxidation addiert.[4]
Reaktionsmechanismus nach Jan Konecny
1955 beschrieb Konecny einen Mechanismus, bei dem zunächst die Hydroxygruppe in einem Radikalmechanismus addiert wird und danach die Nitrosogruppe. Dabei stammt die Hydroxygruppe aus einem Wasserstoffperoxid-Molekül und die Nitrosogruppe von Salpetriger Säure.[5]
Reaktionsmechanismus nach Kazuhiro Maruyama
1967 entdeckte Maruyama angebliche Mängel am Reaktionsmechanismus von Konecny. Da er bei Durchführung der Baudisch-Reaktion mit Salpetriger Säure niedrige Ausbeuten beobachtete, merkte er an, dass eine Nitrosierung eines Phenols mit salpetriger Säure unmöglich sei.[6]
Reaktionsmechanismus nach Zerong Wang
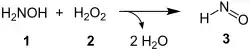
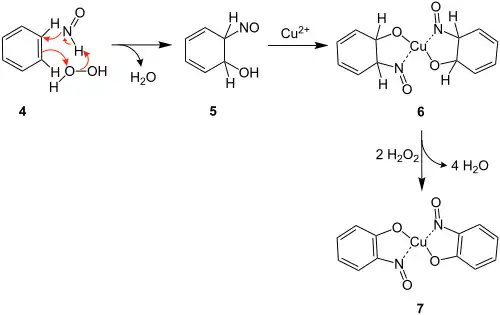
Im von Zerong Wang vorgeschlagenen Reaktionsmechanismus wird zunächst Nitrosylwasserstoff (3) aus Hydroxylamin (1) und Wasserstoffperoxid (2) gebildet:[3]
Das Stickstoffatom des Nitrosylwasserstoffs greift nun das Benzol (4) an, woraufhin dieses eine Bindung zum Wasserstoffperoxid ausbildet. Unter Abspaltung von Wasser entsteht die Zwischenstufe 5. Nach der Reaktion mit einem Kuper(II)-Ion entsteht der Komplex 6. Das gewünschte Produkt 7 entsteht dann durch eine Oxidationsreaktion unter Rearomatisierung.[3][4]
Modifikation
Anstelle des Kupfersalzes können auch andere Metallsalze verwendet werden.[5]
Bei der Baudisch-Reaktion dürfen jedoch keine aromatischen Aldehyde oder primären Amine verwendet werden, da die Aldehydgruppe mit dem Nitrosylrest oder dem Hydroxylamin reagieren würde. Ein primäres Amin würde ebenfalls mit dem Nitrosylrest reagieren.[1][3]
Anwendung
Die Baudisch-Reaktion wurde zu Herstellung von ortho-Nitrosophenolen verwendet.[3]
Einzelnachweise
- Georg Cronheim: o-NITROSOPHENOLS. I. THE TYPICAL PROPERTIES OF o-NITROSOPHENOL AND ITS INNER COMPLEX METAL SALTS. In: The Journal of Organic Chemistry. Band 12, Nr. 1, Januar 1947, S. 1–6, doi:10.1021/jo01165a001.
- Oskar Baudisch: Einfache Bildung von o-Nitrosophenol aus Benzol und Hydroxylamin durch Luftoxydation. Präparative Darstellung von o-Nitrosophenol und Nitrosocresol aus Benzol bzw. Toluol durch H2O2 Oxydation. In: Die Naturwissenschaften. Band 27, Nr. 46, November 1939, S. 768–769, doi:10.1007/BF01498121.
- Wang, Zerong (Daniel Zerong): Comprehensive organic name reactions and reagents. John Wiley, Hoboken, N.J. 2009, ISBN 978-0-471-70450-8, S. 263–266.
- O. Baudisch: A NEW CHEMICAL REACTION WITH THE NITROSYL RADICAL NOH. In: Science. Band 92, Nr. 2389, 11. Oktober 1940, S. 336–337, doi:10.1126/science.92.2389.336.
- Jan O. Konecny: Hydroxylation of Benzene in Aqueous Solution in the Presence of Hydroxylamine Hydrochloride. In: Journal of the American Chemical Society. Band 77, Nr. 21, November 1955, S. 5748–5750, doi:10.1021/ja01626a093.
- Kazuhiro Maruyama, Iwao Tanimoto, Ryozo Goto: Studies on the Baudisch reaction. I. The synthesis of o-nitrosophenols. In: The Journal of Organic Chemistry. Band 32, Nr. 8, August 1967, S. 2516–2520, doi:10.1021/jo01283a033.