Bamford-Stevens-Reaktion
Die Bamford-Stevens-Reaktion – auch Bamford-Stevens-Shapiro-Olefinierung – ist eine Reaktion aus dem Bereich der Organischen Chemie. Sie dient der Synthese von Alkenen aus Ketonen bei gleicher Anzahl von Kohlenstoffatomen in Edukt und Produkt. Die Namensreaktion ist benannt nach ihren Entdeckern William Randall Bamford und Thomas Stevens Stevens.[1]
Übersicht
Die Bamford-Stevens-Reaktion erlaubt die Umwandlung eines Ketons in ein Isomerengemisch aus cis- und trans-Alkenen:
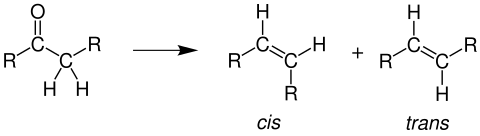
Die Bamford-Stevens-Reaktion ist unterschiedlich durchführbar: Als Base dienen Natriumalkoholate oder wie bei der Shapiro-Reaktion Lithiumalkyle. Abhängig von der Base in protischem oder aprotischem Lösungsmittel. Im protischen Lösungsmittel entstehen Gemische aus (Z)/(E)- Isomeren, wohingegen sich im aprotischen Lösungsmittel vorzugsweise (Z)-Alkene [cis-Alkene] bilden.
Reaktionsmechanismus
Die folgenden Darstellungen zeigen, basierend auf der Literatur,[2][3] einen plausiblen Reaktionsverlauf. Der Mechanismus wird exemplarisch mit Butanon und Methanolat als Base dargestellt. Ar bezeichnet eine Arylgruppe, beispielsweise eine Phenylgruppe. Zunächst wird das Butanon (1) mit einem Arylsulfonhydrazid zum Sulfonylhydrazon 2 umgesetzt. Dieses wird durch das Methanolat deprotoniert:

Unter Abspaltung des Arylsulfinats bildet sich die Diazoverbindung 3. Für den weiteren Verlauf der Reaktion ist entscheidend, ob in protischem oder aprotischem Lösungsmittel gearbeitet wird.
Folgereaktion in protischem Lösungsmittel
In protischen Lösungsmitteln wird im nächsten Schritt vom Lösemittelmolekül ein Proton abstrahiert. Dabei entsteht das Diazoniumsalz 4:
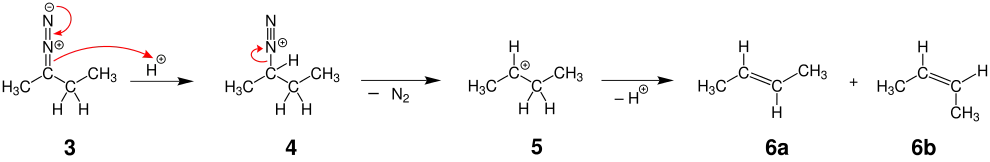
Unter Abspaltung von molekularem Stickstoff wird daraus das Carbokation 5 gebildet. Eine Deprotonierung führt dann zum Alken. Die Eliminierung zur Doppelbindung ist je nach Stabilität des Carbokations unselektiv. Es bilden sich Gemische von (E)-Isomer 6a und (Z)-Isomer 6b.
Folgereaktion in aprotischem Lösungsmittel
Wird die Reaktion in aprotischen Lösungsmitteln durchgeführt, so bildet sich aus der Diazoverbindung 3 unter Abspaltung molekularen Stickstoffs das Carben 7:
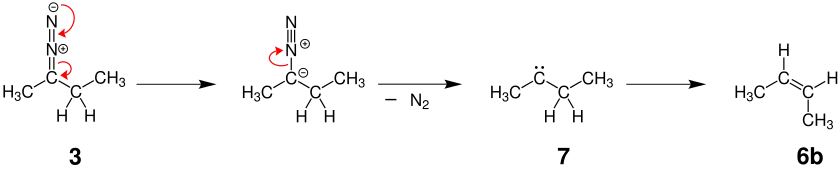
7 reagiert durch eine Hydrid-Verschiebung vorzugsweise zum (Z)-Alken 6b.
Praktische Bedeutung
Die Bamford-Stevens-Reaktion ist ein reines Laborverfahren. Wegen der Bildung stöchiometrischer Mengen mehrerer Abfallstoffe ist die Atomökonomie der Bamford-Stevens-Reaktion so schlecht, dass niemand eine technische Synthese für Alkene basierend auf dieser Reaktion realisiert.
Literatur
- Thomas Laue, Andreas Plagens: Namens- und Schlagwortreaktionen der organischen Chemie. 5. Auflage, Vieweg+Teubner, 2006, ISBN 3-8351-0091-2, S. 26 (eingeschränkte Vorschau in der Google-Buchsuche).
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Burlington/San Diego/London 2005, ISBN 0-12-369483-3.
Einzelnachweise
- W. R. Bamford, T. S. Stevens: The decomposition of toluene-p-sulphonylhydrazones by alkali. In: Journal of the Chemical Society (Resumed). 1952, S. 4735–4740, doi:10.1039/JR9520004735.
- L. Kürti, B. Czakó: Stratigic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Amsterdam 2005, ISBN 978-0-12-429785-2, S. 36.
- T. Laue, A. Plagens: Namen- und Schlagwort-Reaktionen. 5. Auflage, B. G. Teubner/ GWV Fachverlage, Wiesbaden 2006, ISBN 978-3-8351-0091-6, S. 26–27.
Weblinks
- organische-chemie.ch: Bamford-Stevens-Reaktion