BCA-Test
Der BCA-Test ist eine biochemische Methode, um Proteine unter Verwendung von Bicinchoninsäure (BCA) quantitativ zu bestimmen.
Prinzip
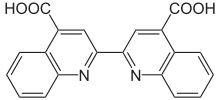
Der BCA-Test wurde 1985 von P. K. Smith und Kollegen veröffentlicht.[1] Er basiert auf dem Lowry-Test von 1951,[2] der wiederum auf die Biuret-Reaktion zur Proteinbestimmung von 1949[3] und das Folin-Ciocalteu-Reagenz von 1927 zurückgreift.[4] Das BCA ersetzt beim BCA-Test das Folin-Ciocalteu-Reagenz im Lowry-Test.[5]
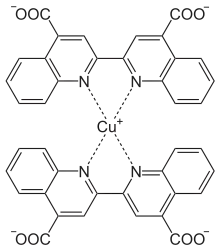
An die Peptidbindung binden zweiwertige Kupferionen und werden bei alkalischem pH-Wert zu einwertigen Kupferionen reduziert. In Anwesenheit von BCA bilden die Kupferionen mit BCA einen blau-violetten Farbstoffkomplex. Bicinchoninsäure ist im alkalischen pH-Wert stabil, wodurch im Gegensatz zum Lowry-Test ein Arbeitsschritt weniger notwendig ist.[6] Die Nachweisgrenze ist vergleichbar mit dem Lowry-Test.[6] Weiterhin ist der BCA-Test weniger störanfällig gegenüber den Chaotropen Harnstoff und Guanidiniumchlorid, gegenüber den Salzen Ammoniumsulfat und Cäsiumhydrogencarbonat und gegenüber den Tensiden Triton X-100, SDS, Brij 35, Lubrol, CHAPS, CHAPSO und Octylglucosid.[6]
Die Reagenzlösung besteht aus den Stammlösungen A (10 g/L Natriumbicinchoninat, 20 g/L Natriumcarbonat, 1,6 g/L Natriumtartrat, 4 g/L Natriumhydroxid, 9,5 g/L Natriumhydrogencarbonat, auf einen pH-Wert von 11,25 mit Natriumhydroxid eingestellt) und B (40 g/L Kupfersulfat-Pentahydrat) in einem Mischungsverhältnis von 50 zu 1.[7] Die Reagenzlösung wird vor Gebrauch frisch aus den Stammlösungen angesetzt.[7] Die Probe wird 1:50 mit der Reagenzlösung verdünnt und 30 Minuten bei 60 °C erhitzt.[7] Der entstandene Farbstoff wird durch Photometrie bei einer Wellenlänge von 562 nm quantifiziert.[7] Während bei Raumtemperatur vor allem die Aminosäuren Cystein, Cystin, Tryptophan und Tyrosin zweiwertige Kupferionen reduzieren, werden die Kupferionen bei 60 °C auch durch die Peptidbindung reduziert, wodurch das Messergebnis weniger von der Aminosäurezusammensetzung der jeweils gemessenen Proteine abhängt.[5]
Literatur
- C. M. Stoscheck: Quantitation of protein. In: Methods in enzymology. Band 182, 1990, S. 50–68, PMID 2314256.
Einzelnachweise
- P. K. Smith, R. I. Krohn, G. T. Hermanson, A. K. Mallia, F. H. Gartner, M. D. Provenzano, E. K. Fujimoto, N. M. Goeke, B. J. Olson, D. C. Klenk: Measurement of protein using bicinchoninic acid. In: Analytical biochemistry. Band 150, Nummer 1, Oktober 1985, S. 76–85, PMID 3843705. doi:10.1016/0003-2697(85)90442-7.
- Oliver H. Lowry et al.: Protein measurement with the Folin phenol reagent. In: J. Biol. Chem. Band 193, Nr. 1, 1951, S. 265–275. PMID 14907713. PDF.
- A. G. Gornall, S. J. Bardawill, M. M. David: Determination of serum proteins by means of the biuret reaction. In: J Biol Chem. Band 177(2), 1949, S. 751–766. PMID 18110453.
- Folin, O., und Ciocalteu, V.: On tyrosine and tryptophane determinations in proteins. In: Journal of Biological Chemistry. 73, 1927, S. 627.
- Olsen BJ, Markwell J: Assays for the Determination of Protein Concentration. In: Current Protocols in Protein Science. 2007, S. 14–17.
- John M. Walker: The Protein Protocols Handbook. Springer Science & Business Media, 2008, ISBN 978-1-603-27259-9, S. 11.
- Alfred Pingoud: Arbeitsmethoden der Biochemie. Walter de Gruyter, 1997, ISBN 978-3-110-16513-5, S. 152.