Argonautenproteine
Argonautenproteine (AGO) sind eine Familie von Proteinen, deren Vertreter evolutionär stark konserviert sind. Sie kommen in fast allen Organismen vor, wo sie eine wichtige Rolle in der Aktivierung und Regulation von Genen spielen. Vertreter der AGO-Familie sind an dem posttranskriptionellen Gen-Silencing (PTGS) beteiligt, wozu die RNA-Interferenz (RNAi) und der durch microRNA bedingte mRNA Abbau zählt.
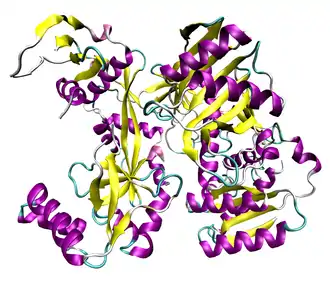
Aufbau
Argonautenproteine sind überwiegend basische Proteine und bestehen aus zwei funktionellen Domänen, PAZ und PIWI; Gesamtmasse ungefähr 100 kDa. Die PAZ-Domäne besteht aus 130 Aminosäuren und kann auch im Protein Dicer gefunden werden. Sie bindet die targetierende si/miRNA und dient evtl. auch als Protein-Protein Interaktions-Domäne zur Endonuclease Dicer. Die C-terminale PIWI-Domäne hat die Mg2+-abhängige Endonucleaseaktivität gegen die zu schneidende Substrat-mRNA.
Einteilung
Eine Einteilung von Argonautenproteinen erfolgt aufgrund von Übereinstimmungen in der Protein-Sequenz in drei Klassen:
- Argonaute-like-Proteins → ähnelt dem Arabidopsis thaliana-Protein AGO1
- PIWI-like-Proteins → starke Verwandtschaft mit PIWI-Protein aus Drosophila melanogaster
- group-3-Argonautes → kürzlich entdeckte Gruppe von Argonautenproteinen in Caenorhabditis elegans
Argonautenproteine sind Bestandteil des sogenannten RNA-induced-silencing-complex (RISC), welcher bei der RNA-Interferenz eine zentrale Rolle spielt. Ago2 bindet die Small-interfering-RNA-Anteil (siRNA) oder micro-RNA (miRNA) und schneidet zunächst deren nicht-targetierenden Komplementärstrang, sodass eine einzelsträngige siRNA/ miRNA entsteht. Nach erfolgreicher Bindung schneidet das Argonautenprotein über eine Endonuklease-Aktivität die Substrat-mRNA. Andernfalls wird die Translation der Substrat-mRNA nur blockiert, wofür keine Endonuklease-Aktivität benötigt wird. Bevor die siRNA binden kann, bilden Argonautenproteine Komplexe mit DICER, in einer Maximalbeschreibung liegen DICER, TRBP, Ago2 und weitere Proteine als Proteinkomplex des RISC vor. Nach Schnitt der Ausgangs-dsRNA zur siRNA bzw. pre-miRNA dissoziiert DICER vom nun aktiven RISC.
Je nach Organismus codiert das Genom 5 (z. B. Taufliegen), 8 (z. B. Mensch) oder sogar bis zu 27 (z. B. Caenorhabditis elegans) Argonautenproteine. Es gibt jedoch auch Organismen, wie z. B. den Parasiten Trypanosoma cruzi, die im Laufe der Evolution ihre gesamte RNAi-Maschinerie abgelegt haben und nur noch katalytisch inaktive AGO-Proteine besitzen.
Literatur
- T. A. Rand u. a.: Biochemical Identification of Argonaute 2 as the sole protein required for RNA induced silencing complex activity. PNAS 2004;101:14385, PMID 15452342
- R. I. Gregory u. a.: Human RISC couples microRNA biogenesis and posttranscriptional gene silencing. Cell 2005;123:631, PMID 16271387
- E. Maniataki, Z. Morelatos: A human, ATP-independent, RISC assembly machine fueled by pre-miRNA. Genes Dev 2005;19:2979, PMID 16357216
- G. Meister, Thomas Tuschl u. a.: Human Argonaute2 mediates RNA cleavage targeted by miRNAs and siRNAs. Mol Cell 2004;15:185, PMID 15260970
- T. A. Rand, X. Wang u. a.: Argonaute2 cleaves the anti-guide strand of siRNA during RISC activation. Cell 2005;123:621, PMID 16271385
- M. A. Carmell, Z. Xuan, M. Q. Zhang, G. J. Hannon: The Argonaute family: tentacles that reach into RNAi, developmental control, stem cell maintenance, and tumorigenesis. Genes Dev. 2002 Nov 1;16(21):2733-42. Review. PMID 12414724
- K. Jaronczyk, J. B. Carmichael, T. C. Hobman: Exploring the functions of RNA interference pathway proteins: some functions are more RISCy than others?. Biochem. J. (2005) 387 (561–571) (Volltext)
- Gyorgy Hutvagner, Martin J. Simard: Argonaute proteins: key players in RNA silencing. Nature Reviews Molecular Cell Biology 9, 22–32 (Januar 2008)
Weblinks
- The microRNA world: small is mighty (PDF; 331 kB)
- David Goodsell: Molecule of the Month: Small Interfering RNA (siRNA)