Anti-Frost-Protein
Anti-Frost-Proteine (AFP), auch Eisstrukturierende Proteine (englisch ice-structuring proteins, ISP), Frostschutzproteine oder thermale Hystereseproteine (THP) sind eine Klasse von Proteinen, die von bestimmten Wirbeltieren, Pflanzen, Pilzen und Bakterien gebildet werden, um in einer Umgebung mit Temperaturen unter dem Gefrierpunkt von Wasser zu überleben.
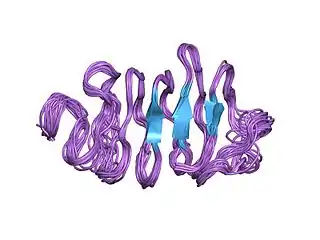
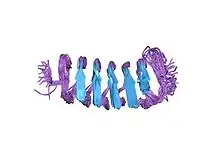
_PDB4dt5.jpg.webp)
Wirkungsweise
Anti-Frost-Proteine binden sich an Eiskristalle und verhindern deren Wachstum und die Rekristallisation, was zum Tode des Lebewesens führen würde. Die Proteine können auch mit Zellmembranen von Säugetieren wechselwirken, um diese vor Frostschäden zu bewahren.
Anders als die handelsüblichen Frostschutzmittel senken die Anti-Frost-Proteine nicht den Gefrierpunkt proportional zu ihrer Konzentration, sondern wirken nicht-kolligativ.[2] AFP erzeugen eine Gefrierpunktserniedrigung und verringern die Bildung von Eiskristallen, indem sie in nicht-kolligativer Weise an die Oberfläche der entstehenden Eiskristalle binden.[3][4] Dies erlaubt ihnen, in Konzentrationen wirksam zu sein, die mehr als 300 bis 500 Mal niedriger sind als die gewöhnlicher gelöster Substanzen beim Frostschutz. Auch haben diese Konzentrationen keinen Einfluss auf den osmotischen Druck. Die ungewöhnlichen Eigenschaften der Anti-Frost-Proteine sind zurückzuführen auf ihre Bindung an die Oberfläche von Eiskristallen.
Lebewesen, die Anti-Frost-Proteine enthalten, können in frost-vermeidende und frost-tolerante Arten eingeteilt werden. Die frostvermeidenden Arten sind in der Lage, ihre Körperflüssigkeiten vollständig gegen das Gefrieren zu schützen. Typischerweise wird jedoch der Gefrierschutz bei extrem niedrigen Temperaturen aufgehoben, was zu einem schnellen Wachstum der Eiskristalle und anschließendem Tod des Lebewesens führt. Die frost-toleranten Arten sind in der Lage, das Gefrieren von Körperflüssigkeiten zu überleben. Einige dieser Arten werden dabei mit den Anti-Frost-Proteinen in Zusammenhang gebracht, die als Kälteschutzmittel wirksam sind und die schädliche Wirkung des Frostes mindern, aber nicht gänzlich aufheben. Die genaue Wirkungsweise ist noch unbekannt. Jedoch kann das Vorhandensein von Anti-Frost-Proteinen die Rekristallisation verhindern, die Zellmembranen stabilisieren und so Frostschäden minimieren.[5] In Fischen sind die Anti-Frost-Proteine größtenteils aus der Aminosäure L-Alanin aufgebaut und mit L-Threonin durchsetzt.[6][7] In Käfern enthalten Anti-Frost-Proteine gehäuft Threonin, z. B. RiAFP.
Entwicklung

Die bemerkenswerte Diversifizierung und Verteilung der Anti-Frost-Proteine lässt vermuten, dass die unterschiedlichen Typen in jüngerer Zeit entstanden sind und zwar als Reaktion auf die Vereisung der Meere etwa ein bis zwei Millionen Jahre in nördlichen Hemisphäre und vor zehn bis dreißig Millionen Jahren in der Antarktis. Die unterschiedliche Entwicklung ähnlicher Anpassungsvorgänge wird als „konvergente Evolution“ bezeichnet. Zwei Gründe sind dafür ausschlaggebend, dass viele Typen von Anti-Frost-Proteinen dieselbe Funktion ausführen können, obwohl sie unterschiedlich aufgebaut sind:
- obwohl Eis durchgehend aus Sauerstoff und Wasserstoff besteht, besitzt es viele verschiedene Oberflächenerscheinungen, die für Bindungen geeignet sind; verschiedene Typen von Anti-Frost-Proteinen können sich so an verschiedenartige Oberflächen anlagern.
- obwohl sich die fünf bekannten Typen von Anti-Frost-Proteinen in ihrer Primärstruktur unterscheiden, weisen sie ähnliche dreidimensionale oder Tertiärstrukturen auf, wenn sie sich zu einem aktiven Protein entfalten.[2][8]
Geschichte
In den 1950er Jahren untersuchte der norwegischstämmige Wissenschaftler Per Fredrik Scholander, warum arktische Fische in Wasser überleben können, das Temperaturen aufweist, die unter dem Gefrierpunkt ihres eigenen Blutes liegen. Seine Experimente veranlassten ihn zu der Annahme, dass es ein Antifrostmittel in ihrem Blut geben müsse.[9] Ende der 1960er Jahre konnte der Zoologe Arthur DeVries das Anti-Frost-Protein durch die Untersuchung von arktischen Fischen isolieren.[10] Seinerzeit wurden sie „Glykoproteine als biologische Antifrost-Mittel“ genannt und anschließend als Antifrost-Glykoproteine bezeichnet, um sie von den neu entdeckten biologischen Anti-Frost-Proteinen zu unterscheiden, die keine Glykoproteine waren. DeVries und Robert Feeney konnten dann die chemischen und physikalischen Eigenschaften der Anti-Frost-Proteine charakterisieren.[11]
1992 publizierte Griffith eine Arbeit zu Anti-Frost-Proteinen in Blättern des Winterweizens. Etwa zur gleichen Zeit dokumentierten Urrutia, Duman und Knight das Wärmehysterese-Protein (thermal hysteresis) in Bedecktsamern.[12] Im Jahr 1993 wurden Anti-Frost-Proteine in Pilzen und Bakterien nachgewiesen.
Diskussion zum Namen
In neuerer Zeit wurde versucht, Anti-Frost-Proteinen den neuen Namen „Eisstrukturierende Proteine“ zu geben, um sie besser von synthetischen Frostschutzmitteln und deren negativem Image abzuheben (z. B. Ethylenglycol).[13] Die beiden Dinge sind vollständig unterschiedliche Stoffklassen und haben nur eine sehr entfernte Ähnlichkeit in ihrer Wirkung.
Literatur
- M. M. Harding, P. I. Anderberg, A. D. Haymet: Antifreeze' glycoproteins from polar fish. In: FEBS Journal. Band 270, Nummer 7, April 2003, S. 1381–1392. PMID 12653993.
- S. R. Inglis, J. J. Turner, M. M. Harding: Applications of type I antifreeze proteins: studies with model membranes & cryoprotectant properties. In: Current Protein & Peptide Science. Band 7, Nummer 6, Dezember 2006, S. 509–522. PMID 17168784.
- J. Barrett: Thermal hysteresis proteins. In: The International Journal of Biochemistry & Cell Biology. Band 33, Nummer 2, Februar 2001, S. 105–117. PMID 11240367.
Einzelnachweise
- S. P. Graether, M. J. Kuiper, S. M. Gagné, V. K. Walker, Z. Jia, B. D. Sykes, P. L. Davies: Beta-helix structure and ice-binding properties of a hyperactive antifreeze protein from an insect. In: Nature. Band 406, Nummer 6793, Juli 2000, S. 325–328. doi:10.1038/35018610. PMID 10917537.
- G. L. Fletcher, C. L. Hew, P. L. Davies: Antifreeze proteins of teleost fishes. In: Annual Review of Physiology. Band 63, 2001, S. 359–390. doi:10.1146/annurev.physiol.63.1.359. PMID 11181960.
- E. Kristiansen, K. E. Zachariassen: The mechanism by which fish antifreeze proteins cause thermal hysteresis. In: Cryobiology. Band 51, Nummer 3, Dezember 2005, S. 262–280. doi:10.1016/j.cryobiol.2005.07.007. PMID 16140290.
- H. Kondo, Y. Hanada, H. Sugimoto, T. Hoshino, C. P. Garnham, P. L. Davies, S. Tsuda: Ice-binding site of snow mold fungus antifreeze protein deviates from structural regularity and high conservation. In: Proceedings of the National Academy of Sciences. Band 109, Nummer 24, Juni 2012, S. 9360–9365. doi:10.1073/pnas.1121607109. PMID 22645341. PMC 3386094 (freier Volltext).
- J. G. Duman: Antifreeze and ice nucleator proteins in terrestrial arthropods. In: Annual Review of Physiology. Band 63, 2001, S. 327–357. doi:10.1146/annurev.physiol.63.1.327. PMID 11181959.
- K. C. Chou: Energy-optimized structure of antifreeze protein and its binding mechanism. In: Journal of Molecular Biology. Band 223, Nummer 2, Januar 1992, S. 509–517. PMID 1738160.
- G. C. Barrett: Chemistry and Biochemistry of the Amino Acids. Chapman and Hall, London, New York, 1985, ISBN 0-412-23410-6, S. 11.
- L. Chen, A. L. DeVries, C. H. Cheng: Convergent evolution of antifreeze glycoproteins in Antarctic notothenioid fish and Arctic cod. In: Proceedings of the National Academy of Sciences. Band 94, Nummer 8, April 1997, S. 3817–3822. PMID 9108061. PMC 20524 (freier Volltext).
- P. F. Scholander, L. van Dam, J. W. Kanwisher, H. T. Hammel, M. S. Gordon: Supercooling and osmoregulation in arctic fish. In: Journal of Cellular and Comparative Physiology. Band 49, Nr. 1, Februar 1957, S. 5–24, doi:10.1002/jcp.1030490103.
„When arctic fishes swim about in ice water at –1.7° to - 1.8°, why don't they freeze? Do they have twice as high an oscmotic concentration as ordinary fishes, or what is the story?“
- A. L. DeVries, D. E. Wohlschlag: Freezing resistance in some Antarctic fishes. In: Science. Band 163, Nummer 3871, März 1969, S. 1073–1075. PMID 5764871.
- A. L. DeVries, S. K. Komatsu, R. E. Feeney: Chemical and physical properties of freezing point-depressing glycoproteins from Antarctic fishes. In: The Journal of Biological Chemistry. Band 245, Nummer 11, Juni 1970, S. 2901–2908. PMID 5488456.
- John G. Duman, T.Mark Olsen: Thermal Hysteresis Protein Activity in Bacteria, Fungi, and Phylogenetically Diverse Plants. In: Cryobiology. 30, 1993, S. 322–328, doi:10.1006/cryo.1993.1031.
- C. J. Clarke, S. L. Buckley, N. Lindner: Ice structuring proteins – a new name for antifreeze proteins. In: CryoLetters. Band 23, Nummer 2, 2002 Mar-Apr, S. 89–92. PMID 12050776.