Ammoniumsulfit
Ammoniumsulfit ist eine anorganische chemische Verbindung aus der Gruppe der Sulfite.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
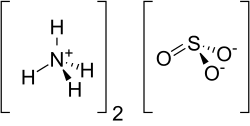 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumsulfit | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | (NH4)2SO3 | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 116,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
1,41 g·cm−3 (Monohydrat)[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Ammoniumsulfit entsteht bei der Rauchgasentschwefelung bei dem Schwefeldioxid nach Zugabe von Ammoniak aus den abgekühlten Rauchgasen ausgewaschen wird.[4] Es entsteht auch bei der Zersetzung von Ammoniumthiosulfat.
Eigenschaften
Ammoniumsulfit ist ein brennbarer, weißer, geruchloser Feststoff, der leicht in Wasser löslich ist. Er zersetzt sich bei Erhitzung über 60–70 °C.[2]
Verwendung
Ammoniumsulfit wird zur Herstellung des Lebensmittelfarbstoffes Ammoniumsulfit-Couleur (E150d) verwendet.[5]
Einzelnachweise
- Eintrag zu AMMONIUM SULFITE in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Oktober 2021.
- Eintrag zu Ammoniumsulfit in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Juli 2014. (JavaScript erforderlich)
- Eintrag zu Ammonium Sulfite in der Hazardous Substances Data Bank, abgerufen am 29. Juli 2014 (online auf PubChem).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 656.
- Werner Baltes, Reinhard Matissek: Lebensmittelchemie. Springer-Verlag, 2011, S. 258 (eingeschränkte Vorschau in der Google-Buchsuche).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.
