Ah-Rezeptor
Der Aryl-Hydrocarbon-Rezeptor (AhR, Ah-Rezeptor, auch Dioxinrezeptor (veraltet)) ist ein Liganden-aktivierter Transkriptionsfaktor aus der PAS-Familie (Per-ARNT-Sim-Familie) der basischen helix-loop-helix-Familie. Der AhR liegt in nicht-aktiver Form im Cytosol in einem Komplex mit weiteren Proteinen (hsp90, AIP, p23) vor. Nach Bindung an einen Liganden und dadurch verursachter Konformationsänderung löst sich der Protein-Komplex auf und die Translokation in den Zellkern ist möglich. Innerhalb des Zellkerns bildet der Ah-Rezeptor ein Dimer mit dem Protein ARNT und kann somit an bestimmte kurze DNA-Sequenzen in Genpromotoren binden. Hierdurch wird die Transkription des betreffenden Genes ausgelöst. Der AhR degradiert nach Verlassen des Zellkernes wieder. Die Affinität des AhR zu Liganden ist in verschiedenen Spezies unterschiedlich. Darüber hinaus sind auch Genvarianten bekannt, die zu unterschiedlicher Affinität führen. Der AhR ist in vielen Zellen vorhanden, besonders ausgeprägt ist er in Zellen von Grenzflächenorganen wie Haut, Darm und Lunge, sowie in den meisten Zellen des Immunsystems.[2]
| Ah-Rezeptor | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 838 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Heterodimer | |
| Kofaktor | HLH-Protein | |
| Bezeichner | ||
| Gen-Name | AHR | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Wirbeltiere[1] | |
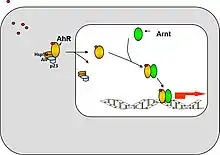
Zielgene des Ah-Rezeptors
Zahlreiche Gene enthalten eine oder mehrere AhR Bindungsstelle in ihrem Promotor und sind daher potentielle Zielgene[3]. Die Stärke der induzierten Transkription schwankt und scheint von der Qualität und Positionierung der AhR-responsiven Promoterelemente, sowie zell-spezifischen Faktoren abzuhängen. Gut untersucht ist die Induktion von Genen des fremdstoffmetabolisierenden Enzymsystems, insbesondere Cytochrom P450 1A1. Dieses Enzym gehört zu den Phase I Enzymen und baut Ringmoleküle ab, darunter auch Liganden des AhR selbst. In der Tat war eine der ersten entdeckten Funktionen des AhR der Abbau von polyzyklischen Kohlenwasserstoffen (Arylhydrocarbone). Weitere nachgewiesene Zielgene wurden im Immunsystem identifiziert (TGFβ, IL-2, IL-22, c-kit).
Liganden des Ah-Rezeptors
Der AhR hat nur eine Bindungsstelle und kann eine Vielzahl von strukturverschiedenen Molekülen binden, sofern sie eine gewissen Größe und planare Form aufweisen[4]. Dies sind sowohl eine Reihe von polyzyklischen Kohlenwasserstoffe wie Benzo[a]pyren, Dioxine oder Furane, als auch aus Pflanzen stammende Moleküle und Indolderivate. Aus der Aminosäure Tryptophan kann durch Sonnenlicht das Molekül 6-Formylindole[3,2b]carbazol in der Haut gebildet werden[5]. Ebenso sind Kynurenine (Metabolite von Tryptophan) bekannte AhR-Liganden. Die Affinität der verschiedenen Liganden ist sehr unterschiedlich. Hochaffine Liganden (Kd-Werte <10−9 M) sind TCDD (2,3,7,8-Tetrachlordibenzo-p-dioxin), Indolocarbazol, ITE (Indolylcarboxythiazolcarbonsäuremethylester) und FICZ (6-Formylindole[3,2b]carbazol), niedrigaffine Liganden sind z. B. Kynurenin (Kd 10−6 M, also etwa 1000-fach schlechtere Bindungskraft). Liganden werden nach Aktivierung des AhR wieder abgebaut. Ausnahme ist TCDD, das kaum verstoffwechselt wird und im Menschen ein sehr lange Halbwertszeit von ca. 7 Jahren hat.
Funktionen des Ah-Rezeptors
Die Aufgaben des Rezeptors liegen in der Metabolisierung (Verstoffwechselung) von organischen Molekülen, Kontrolle des Zellwachstums und der zellulären Differenzierung. In den Jahren seit 2008 listete die Datenbank für biologisch-medizinische Literatur PubMed jährlich 300–500 Fachartikel zum Stichwort aryl hydrocarbon receptor.[6]
Eine wichtige Funktion hat der Rezeptor für das Immunsystem[7].
Der AhR ist relevant in der Kanzerogenese und Tumor-Evasion, u. a. können Tumore mithilfe des AhR für sich ein immungeschwächtes Mikromilieu erzeugen[8].
Im Darm werden von verschiedenen Darmbakterien Liganden des AhR gebildet, die für ein funktionierendes Darmimmunsystem wichtig sind.[9] Auch über die Nahrung können AHR-Liganden aufgenommen werden. Fehlen des AHR und eine AHR-ligandenarme Diät wurden bei Mäusen mit einer geschwächten Darmbarriere assoziiert.[10][11]
Modulator
Tapinarof ist ein nichtsteroidaler Modulator des Ah-Rezeptors, dessen topischer Einsatz zur Behandlung der Psoriasis und der atopischen Dermatitis in der Entwicklung ist. Er hat eine immunmodulierende, Haut-stabilisierende und antioxidative Wirkung.[12]
Einzelnachweise
- Homologe bei OMA
- Bruno Lamas, Jane M. Natividad, Harry Sokol: Aryl hydrocarbon receptor and intestinal immunity. In: Mucosal Immunology. 7. April 2018, ISSN 1933-0219, doi:10.1038/s41385-018-0019-2 (nature.com [abgerufen am 4. Mai 2018]).
- Y. V. Sun: Comparative analysis of dioxin response elements in human, mouse and rat genomic sequences. In: Nucleic Acids Research. Band 32, Nr. 15, 18. August 2004, ISSN 1362-4962, S. 4512–4523, doi:10.1093/nar/gkh782 (oup.com [abgerufen am 4. Mai 2018]).
- Michael S. Denison, Scott R. Nagy: Activation of the Aryl Hydrocarbon Receptor by Structurally Diverse Exogenous and Endogenous Chemicals. In: Annual Review of Pharmacology and Toxicology. Band 43, Nr. 1, 1. April 2003, ISSN 0362-1642, S. 309–334, doi:10.1146/annurev.pharmtox.43.100901.135828 (annualreviews.org [abgerufen am 4. Mai 2018]).
- Emma Wincent, Nahid Amini, Sandra Luecke, Hansruedi Glatt, Jan Bergman: The Suggested Physiologic Aryl Hydrocarbon Receptor Activator and Cytochrome P4501 Substrate 6-Formylindolo[3,2-b]carbazole Is Present in Humans. In: Journal of Biological Chemistry. Band 284, Nr. 5, 30. Januar 2009, ISSN 0021-9258, S. 2690–2696, doi:10.1074/jbc.M808321200, PMID 19054769 (jbc.org [abgerufen am 4. Mai 2018]).
- pubmeddev: aryl hydrocarbon receptor – PubMed – NCBI. Abgerufen am 4. Mai 2018.
- Charlotte Esser, Agneta Rannug: The Aryl Hydrocarbon Receptor in Barrier Organ Physiology, Immunology, and Toxicology. In: Pharmacological Reviews. Band 67, Nr. 2, 1. April 2015, ISSN 0031-6997, S. 259–279, doi:10.1124/pr.114.009001, PMID 25657351 (aspetjournals.org [abgerufen am 4. Mai 2018]).
- Ping Xue, Jinrong Fu, Yufeng Zhou: The Aryl Hydrocarbon Receptor and Tumor Immunity. In: Frontiers in Immunology. Band 9, 2018, ISSN 1664-3224, doi:10.3389/fimmu.2018.00286 (frontiersin.org [abgerufen am 4. Mai 2018]).
- J. Gao, K. Xu u. a.: Impact of the Gut Microbiota on Intestinal Immunity Mediated by Tryptophan Metabolism. In: Frontiers in cellular and infection microbiology. Band 8, 2018, S. 13, doi:10.3389/fcimb.2018.00013. PMID 29468141, PMC 5808205 (freier Volltext) (Review)
- T. D. Hubbard, I. A. Murray u. a.: Dietary Broccoli Impacts Microbial Community Structure and Attenuates Chemically Induced Colitis in Mice in an Ah receptor dependent manner. In: Journal of functional foods. Band 37, Oktober 2017, S. 685–698, doi:10.1016/j.jff.2017.08.038. PMID 29242716, PMC 5726276 (freier Volltext).
- J. M. Natividad, A. Agus u. a.: Impaired Aryl Hydrocarbon Receptor Ligand Production by the Gut Microbiota Is a Key Factor in Metabolic Syndrome. In: Cell metabolism. [elektronische Veröffentlichung vor dem Druck] Juli 2018, doi:10.1016/j.cmet.2018.07.001. PMID 30057068.
- Mark G. Lebwohl, Linda Stein Gold, Bruce Strober, Kim A. Papp, April W. Armstrong, Jerry Bagel, Leon Kircik, Benjamin Ehst, H. Chih-ho Hong, Jennifer Soung, Jeff Fromowitz, Scott Guenthner: Phase 3 Trials of Tapinarof Cream for Plaque Psoriasis New England Journal of Medicine 2021, Band 385, Ausgabe 24 vom 9. Dezember 2021, Seiten 2219–2229, DOI: 10.1056/NEJMoa2103629