2-Elektronen-3-Zentren-Bindung
In einer 2-Elektronen-3-Zentren-Bindung teilen sich drei Atome ein Elektronenpaar. Dieser Bindungstyp findet sich bei nur wenigen Elementen, z. B. Beryllium (zweite Hauptgruppe) und Bor (dritte Hauptgruppe). Sie neigen zu kovalenten Bindungen, besitzen wenige Valenzelektronen und erreichen so kein vollständiges Elektronenoktett. Zur Valenzabsättigung lagern sich offene 2-Elektronen-3-Zentrengruppierungen deshalb zu Dimeren oder höheren Agglomeraten zusammen. Das Konzept der 2-Elektronen-3-Zentren-Bindung wurde 1949 von H. C. Longuet-Higgins entwickelt und von W. N. Lipscomb erweitert und verfeinert.[1][2]
Theorie der Bindungsbildung
Entsprechend der Molekülorbitaltheorie kombiniert man Atomorbitale durch Linearkombination von Atomorbitalen. Als Bedingung für die Kombination müssen die Atomorbitale vergleichbare Energien besitzen, sich räumlich genügend überlappen und eine passende Symmetrie aufweisen. Bei der 2-Elektronen-3-Zentren-Bindung bilden sich drei Molekülorbitale. Hiervon ist eines stets bindend, eines stets antibindend und das dritte entweder nichtbindend oder schwach bindend bzw. antibindend. Die beiden Elektronen besetzen das bindende Molekülorbital.
Man unterscheidet zwischen offenen Dreizentrenbindungen (Brückenbindungen) und geschlossenen (zentrierten) Dreizentrenbindungen. Ein gutes Beispiel für Dreizentrenbindungen findet sich in der Chemie der Borane. Bei den Boratomen ist jeweils ein 2sp3-Orbital beteiligt und im Fall der offenen Dreizentrenbindung das 1s-Orbital des Wasserstoffatoms.
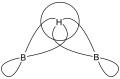 B-H-B Dreizentrenbindung
B-H-B Dreizentrenbindung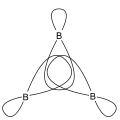 Zentrierte B,B,B Dreizentrenbindung
Zentrierte B,B,B Dreizentrenbindung
Einzelnachweise
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. VCH 1988, S. 199.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3.