Zerebraler Blutfluss
Der zerebrale Blutfluss (CBF von englisch Cerebral blood flow) ist ein Maß für die Versorgung des Gehirns mit Blut in einer bestimmten Zeiteinheit. Obwohl das Gehirn bei einem erwachsenen Menschen nur ca. 2 % der Körpermasse ausmacht, stellt der zerebrale Blutfluss etwa 15 % des Herzzeitvolumens dar und beträgt ca. 750 Milliliter pro Minute. Um Größenunterschieden gerecht zu werden, wird der zerebrale Blutfluss meist als Flussvolumen pro 100 g Gehirnmasse und Minute mit der Einheit ml/100 g/min angegeben.
Im Gegensatz zum gesamten zerebralen Blutfluss stellt der regionale zerebrale Blutfluss (rCBF) ein Maß für die Durchblutung bestimmter Hirnareale dar. Durch die Bestimmung des rCBF kann man mehr- oder minderdurchblutete Bereiche des Gehirns identifizieren. Auch der rCBF wird in der Einheit ml/100 g/min angegeben, wobei die gemessenen Werte stark methodenabhängig sind.
Physiologie und Anatomie
Das Kapillarbett des Gehirns besteht aus einem engen Netzwerk von miteinander kommunizierenden Gefäßen. Die Gesamtlänge der Kapillaren im menschlichen Gehirn beträgt ca. 640 Kilometer.[1] Der intravaskuläre Druckunterschied zwischen den präkapillären Arteriolen und den postkapillären Venolen ist der wichtigste Regulator für den Blutfluss durch die Kapillaren. Er wird vor allem durch die Stellung der als Widerstandsgefäße fungierenden Arteriolen bestimmt, deren Erweiterung zu einer Erhöhung des mikrovaskulären Kapillarflusses führt.
Unter physiologischen Bedingungen bestehen Unterschiede zwischen dem zerebralen Blutfluss in der grauen und in der weißen Substanz des Gehirns.[2] Die graue Substanz, die eine etwa 4-mal höhere Kapillardichte als die weiße Substanz aufweist, wird pro Minute mit ca. 90 ml/100 g versorgt. In der weißen Substanz beträgt der Blutfluss dagegen lediglich ca. 25 ml pro 100 g Substanz und Minute.[3] Daraus resultiert für das gesamte Gehirn ein Blutfluss von 40 bis 50 ml/100g/min.[4]
Regulationsmechanismen
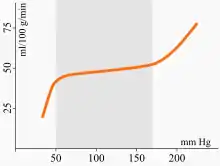
Um eine ausreichende und gleichmäßige Versorgung des Gehirns mit Blut und damit mit Sauerstoff und Nährstoffen sicherzustellen, wird der zerebrale Blutfluss bei Schwankungen des systemischen Blutdrucks über einen relativ weiten Blutdruckbereich konstant gehalten.
Er wird durch den mittleren systemischen arteriellen Druck (MAP), den intrakraniellen Druck (ICP) und dem Widerstand der zerebralen Gefäße (zerebraler Gefäßwiderstand (CVR)) bestimmt und kann nach folgender Formel berechnet werden:
- CBF = (MAP – ICP) / CVR
Die Differenz zwischen dem mittleren arteriellen Blutdruck (MAP) bzw. dem mittleren Aortendruck[5] und dem intrakraniellen Druck (ICP) bezeichnet man auch als den zerebralen Perfusionsdruck (CPP):
- CPP = MAP – ICP
Der wesentliche Parameter bei der Regulation des zerebralen Blutflusses ist der Widerstand der zerebralen Gefäße, der entsprechend dem mittleren arteriellen Druck reguliert wird. Über den sogenannten Bayliss-Effekt verengen sich die Arteriolen bei einem Anstieg des systemischen Blutdrucks (Vasokonstriktion), während sie sich bei einem Blutdruckabfall erweitern (Vasodilatation).[6] Bei einem gesunden Menschen gelingt es dem Körper, über diesen als Autoregulation bezeichneten Mechanismus, den zerebralen Blutfluss bei einem systemischen Blutdruck im Bereich zwischen 50 und 150 mmHg konstant zu halten.[7]
Außerdem reagieren die Arteriolen auch auf die Konzentration der im Blut gelösten Gase.[8] So führt ein bei konstantem systemischen Blutdruck erhöhter CO2-Partialdruck im arteriellen Blut zu einer Erweiterung der Hirngefäße, wodurch eine Steigerung der Gehirndurchblutung erreicht wird. Umgekehrt reagieren die Gefäße auf eine Abnahme des CO2-Partialdruckes mit einer Konstriktion, was zu einer Zunahme des zerebralen Gefäßwiderstandes und damit eine Reduktion des zerebralen Blutflusses führt. Der Sauerstoffpartialdruck hat dagegen nur einen untergeordneten Einfluss auf den zerebralen Gefäßwiderstand. Erst ab einem pO2-Wert von unter 50 mmHg im arteriellen Blut, reagieren die zerebralen Gefäße mit einer Erweiterung, so dass es zu einer Zunahme der Durchblutung kommt.
Weiterhin beeinflussen die sympathische und parasympathische Innervation der größeren Gefäße sowie die Reaktion der Gefäßmuskulatur der Arteriolen auf endokrine und chemische Faktoren (pH-Wert, Adenosin, Kalium) den Gefäßwiderstand.[8]
Messung
Der globale zerebrale Blutfluss kann durch Anwendung des Fickschen Prinzips nach einer von dem Neurowissenschaftler Seymour S. Kety entwickelten Methode bestimmt werden.[9] Dabei inhaliert der Proband Distickstoffmonoxid (N2O) in niedriger Konzentration, dessen Konzentration anschließend in einer aus der V. jugularis interna entnommenen Blutprobe bestimmt wird. Durch die Multiplikation des so ermittelten CBF mit der jeweiligen Konzentrationsdifferenz zwischen arteriellem und venösem Blut können außerdem Stoffwechselrate des Gehirns für bestimmte Metabolite wie zum Beispiel Sauerstoff, Kohlendioxid, Glucose oder Laktat bestimmt werden. Für die Etablierung der Methode wurde Kety 1988 mit dem NAS Award in the Neurosciences ausgezeichnet.[10]
Der Blutfluss in bestimmten Hirnarealen, der als regionaler zerebraler Blutfluss (rCBF) bezeichnet wird, kann durch verschiedene bildgebende Verfahren am lebenden Organismus gemessen werden, um minderdurchblutete Bereiche des Gehirns identifizieren zu können. Zur Bestimmung des rCBF wird unter anderem die Positronen-Emissions-Tomographie (PET), die SPECT, die Xenon-Computertomographie, die transkranielle Dopplersonographie und die Magnetresonanztomographie (MRT) eingesetzt. Auch der rCBF wird in der Einheit ml/100 g/min angegeben, wobei die gemessenen Werte stark methodenabhängig sind, weshalb methodenspezifische Referenzwerte herangezogen werden.
Pathophysiologie und Dysregulation
Wenn der systemische Blutdruck unter 50 mmHg oder über 150 mmHg liegt, kann der Autoregulationsmechanismus diesen durch die Anpassung des Gefäßdurchmessers nicht mehr kompensieren und der zerebrale Blutfluss folgt druckpassiv linear dem zentralen Perfusionsdruck (CPP).[11]
Ein zu geringer Blutfluss (Ischämie) führt zu einer Unterversorgung des Gehirns mit Sauerstoff und Nährstoffen. Eine Verringerung des Blutflusses um die Hälfte kann das Gehirn zunächst noch durch eine verbesserte Sauerstoffausschöpfung kompensieren. Eine kurzfristige Reduktion auf unter 20 ml pro 100g und Minute führt bereits zu reversiblen Veränderungen an den Gehirnzellen. Wenn die Durchblutungsrate auf weniger als 15 ml pro 100g und Minute sinkt, kommt es innerhalb von einigen Minuten bis weniger Stunden zum endgültigen Absterben von Nervenzellen.[12]
Eine zu starke Durchblutung (Hyperämie) des Gehirns kann zu einem Anstieg des intrakraniellen Druckes führen, der zu einer Schädigung des empfindlichen Hirngewebes führen kann. Bei einer massiven akuten Überschreitung der Regulationsgrenze des systemischen Blutdrucks über 150 mmHg, z. B. bei einer hypertensiven Krise, kommt es zu einer starken Zunahme des zerebralen Blutflusses und des zentralen Perfusionsdruckes (CPP) mit einer Störung der Blut-Hirn-Schranke. Durch den Austritt von Plasmaproteinen aus den Blutgefäßen kann sich ein Hirnödem entwickeln.[8]
Bei dauerhaftem Bluthochdruck verschieben sich die Grenzen der autoregulatorischen Anpassung nach oben, wodurch der Körper versucht, sich an die veränderten Parameter anzupassen.[13] Auch durch über einen längeren Zeitraum bestehenden und schlecht eingestellten Diabetes mellitus kann die Autoregulation insgesamt gestört werden.
Beim reversiblen zerebralen Vasokonstriktionssyndrom kommt es zu einer kurzzeitigen segmentalen arteriellen Vasokonstriktion, wodurch eine schlagartige Minderdurchblutung der betroffenen Areale ausgelöst wird.[14] Hauptsymptom ist ein plötzlich einsetzender Vernichtungskopfschmerz, der je nach betroffener Hirnregion mit anderen neurologischen Ausfällen einhergehen kann.
Siehe auch
Einzelnachweise
- D. J. Begley DJ, M. W. Brightman: Structural and functional aspects of the blood–brain barrier. In: Prog Drug Res. (61) 2003, S. 39–78.
- D. M. Hermann, T. Steiner, H. C. Diener: Vaskuläre Neurologie: Zerebrale Ischämien, Hämorrhagien und vaskuläre Demenz.Georg Thieme Verlag, 2010, S. 8
- Otto Detlev Creutzfeldt: Allgemeine Neurophysiologie der Hirnrinde. In: Otto Detlev Creutzfeldt (Hrsg.): Cortex cerebri. Springer Verlag, Berlin 1983, ISBN 3-540-12193-5.
- H. Ito, I. Kanno, H. Fukuda: Human cerebral circulation: positron emission tomography studies. In: Annals of nuclear medicine. Band 19, Nummer 2, April 2005, S. 65–74, ISSN 0914-7187. PMID 15909484.
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin/Heidelberg/New York u. a. 1999, ISBN 3-540-65024-5, S. 445.
- Kandel E.R., Schwartz, J.H., Jessell, T.M. 2000. Principles of Neural Science, 4th ed., McGraw-Hill, New York. p.1305
- E. Kochs, H. A. Adams,C. Spies: Anästhesiologie. Georg Thieme Verlag, 2008, S. 264
- E. Kochs, H. A. Adams,C. Spies: Anästhesiologie. Georg Thieme Verlag, 2008, S. 265
- S. S. Kety, C. F. Schmidt: The nitrous oxide method for the quantitative determination of cerebral blood flow in man; theory, procedure and normal values. In: The Journal of clinical investigation. Band 27, Nummer 4, Juli 1948, S. 476–483, ISSN 0021-9738. doi:10.1172/JCI101994. PMID 16695568. PMC 439518 (freier Volltext).
- NAS Award in the Neurosciences bei der National Academy of Sciences (nasonline.org); abgerufen am 25. Dezember 2014
- E. Kochs, H. A. Adams,C. Spies: Anästhesiologie. Georg Thieme Verlag, 2008, S. 263
- Klaus Poeck, Werner Hacke: Neurologie. 10. vollständig überarbeitete Auflage. Springer, Berlin 1998, ISBN 3-540-63028-7.
- L. Edvinsson, E.T. MacKenzie, J. McCulloch: Cerebral Blood Flow and Metabolism. Raven, New York 1993, ISBN 0-88167-918-6.
- Ducros A. Reversible cerebral vasoconstriction syndrome. In: The Lancet Neurology (11) 2012, S. 906–917.