Vanillat-Monooxygenase
Die Vanillat-Monooxygenase (VAN, EC 1.14.13.82), auch als Vanillat-Demethylase bezeichnet, katalysiert die Umsetzung von Vanillat, dem Anion der Vanillinsäure, zu Protocatechusäure. Dabei wird NADH zu NAD+ oxidiert, je nach Spezies kann aber auch NADPH als Elektronendonor fungieren.[1] Als Monooxygenase verbraucht das Enzym Sauerstoff (O2), wobei Formaldehyd und Wasser gebildet werden:
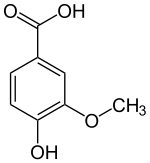 + O2 + NAD(P)H + H+
+ O2 + NAD(P)H + H+ 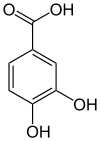 + NAD(P)+ + H2O + CH2O
+ NAD(P)+ + H2O + CH2O
| Vanillat-Monooxygenase | ||
|---|---|---|
| Kofaktor | NAD(P)+, [2Fe2S] | |
| Bezeichner | ||
| Gen-Name(n) | vanA, vanB | |
| Externe IDs |
| |
| Enzymklassifikation | ||
| EC, Kategorie | 1.14.13.82, Monooxygenase | |
| Substrat | Vanillinsäure, O2, NAD(P)H + H+ | |
| Produkte | Protocatechusäure, H2O, Formaldehyd, NAD(P)+ | |
| Vorkommen | ||
| Übergeordnetes Taxon | Bakterien | |
VAN wurde in Pseudomonas-, Acinetobacter- und Corynebacteriumstämmen identifiziert.[2]
Die Vanillat-Monooxygenase ist ein heterodimeres Enzym und setzt sich aus einer Oxygenase- und einer Oxidoreduktaseuntereinheit zusammen. Erstere wird vom vanA-Gen, zweitere von vanB-Gen kodiert, sie sind enge Homologe.[3] VanB weist zudem eine konservierte NAD-Ribose-Bindedomäne und eine Eisen-Schwefel-Domäne auf.[2]
Die Umsetzung von Vanillat zu Protocatechusäure ein Zwischenschritt beim Abbau von Lignin. Während Weißfäulepilze Lignin depolymerisieren, können bakterielle Mikroorganismen die entstandenen, aromatischen Abbauprodukte weiter umsetzen. Bei Protocatechusäure erfolgt schließlich eine Ringspaltung und die weitere Metabolisierung. Das bei der von VAN katalysierten Reaktion freiwerdende Formaldehyd wird durch eine Glutathion-abhängige Formaldehyd-Dehydrogenase (EC 1.2.1.1) umgesetzt, da es sehr toxisch ist.[1]
Einzelnachweise
- Makoto Hibi, Tomonori Sonoki, Hideo Mori: Functional coupling between vanillate-O-demethylase and formaldehyde detoxification pathway. In: FEMS Microbiol. Lett., 2005, 253 (2); S. 237–242; doi:10.1016/j.femsle.2005.09.036; PMID 1624286.
- M. Nishimura, D. Ishiyama, J. Davies: Molecular cloning of streptomyces genes encoding vanillate demethylase. In: Bioscience, Biotechnology, and Biochemistry, Band 70, Nummer 9, September 2006, S. 2316–2319. PMID 16960359.
- Miguel A. Providenti, Jason M. O’Brien, Jürgen Ruff, Alasdair M. Cook, Iain B. Lambert: Metabolism of isovanillate, vanillate, and veratrate by Comamonas testosteroni strain BR6020. In: J. Bacteriol., 2006, 188 (11), S. 3862–3869; PMID 16707678; PMC 1482911 (freier Volltext).