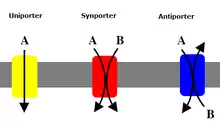
Uniporter
Ein Uniporter ist ein Protein, das einen Membrantransport von einem Molekül vermittelt.[1] Weitere Proteintypen des Membrantransportes sind Antiporter und Symporter.
Eigenschaften
Ein Uniporter ist ein Membranprotein, das den Transport von einem Molekül (Uniport) meistens durch einen passiven Transport ermöglicht. Der passive Transport wird energetisch durch Diffusion entlang eines Gradienten der Konzentration der transportierten Molekülsorte getrieben, der gelegentlich andernorts unter Adenosintriphosphat-Verbrauch aufgebaut wurde. Manche Uniporter verbrauchen dagegen beim Antiport ATP (primär aktiv). Uniporter ermöglichen eine Form der erleichterten Diffusion.
Transportmodell
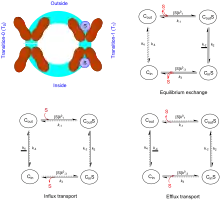
S: Substrat,
kn (unterstrichen): geschwindigkeitsbestimmender Schritt (für GLUT-1),
➔: bevorzugte(r) Weg(e),
⤏: nicht-bevorzugte(r) Weg(e)
In den 1960er-Jahren schlug Oleg Jardetzky ein allgemeines Modell (alternating-access-Modell oder Jardetzky-Modell) für Transporter einschließlich Uniporter vor,[2] und zwar war dies der erste Versuch, eine Hypothese über den Zusammenhang zwischen Thermodynamik und Struktur eines Transporters aufzustellen. Aus theoretischer Sicht ist das Jardetzky-Modell ein typisches Beispiel für das sogenannte Zweizustandssystem in der Physik, das in der Biologie breite Anwendung gefunden hat.[3] Besonders bei MFS-Transportern wird das Modell als rocker-switch-Modell (deutsch: Kippbewegung) bezeichnet. Das Jardetzky-Modell setzt drei charakteristische Merkmale voraus:[4]
- Ein Transporter muss in seinem Inneren einen Hohlraum aufweisen, der groß genug ist, um das Substrat aufzunehmen.
- Es muss in der Lage sein, zwei verschiedene Konformationen anzunehmen, damit der Molekülhohlraum in einer Konformation zu einer Seite der Membran und in der anderen zur gegenüberliegenden Seite offen ist.
- Es muss eine Bindungsstelle für Substrate in dem Hohlraum enthalten, deren Substrataffinität in den zwei Konformationen unterschiedlich sein kann.
Die Konformation von Uniportern ist entweder intrazellulär (Cin) oder extrazellulär (Cout) gerichtet.[5][6][7] Dabei kann jede Konformation entweder mit einem Substrat besetzt oder unbesetzt sein. Um einen Transportzyklus zu beschreiben, sind daher vier Schritte nötig. Dabei ist zu beachten, in welchem Zustand sich das Transportsystem befindet: im Gleichgewicht, unter Ausfluss oder unter Zufluss. Für jedes dieser Zustände kann man einen eigenen King–Altman plot (King-Altman-Diagramm) erstellen. Daraus ergibt sich zur Beschreibung eines Transportzyklus von Uniporter das two-state four-step-Modell.[4]
Einer der am intensivsten untersuchten eukaryotischen Uniporter ist der Glucosetransporter GLUT-1.[8][9]
Einzelnachweise
- M. G. Wolfersberger: Uniporters, symporters and antiporters. In: The Journal of experimental biology. Band 196, November 1994, S. 5–6, ISSN 0022-0949. PMID 7823043.
- Oleg Jardetzky: Simple Allosteric Model for Membrane Pumps. In: Nature. 211, 1966, S. 969, doi:10.1038/211969a0.
- R. Phillips, J. Kondev, J. Theriot: Physical biology of the cell. 2. Auflage. Garland Science, New York 2013, ISBN 978-0-8153-4450-6.
- Xuejun C. Zhang, Lei Han: Uniporter substrate binding and transport: reformulating mechanistic questions. In: Biophysics Reports. 2, 2016, S. 45, doi:10.1007/s41048-016-0030-7.
- J. Abramson, I. Smirnova, V. Kasho, G. Verner, H. R. Kaback, S. Iwata: Structure and mechanism of the lactose permease of Escherichia coli. In: Science. Band 301, Nummer 5633, August 2003, S. 610–615, doi:10.1126/science.1088196, PMID 12893935.
- Y. Huang, M. J. Lemieux, J. Song, M. Auer, D. N. Wang: Structure and mechanism of the glycerol-3-phosphate transporter from Escherichia coli. In: Science. Band 301, Nummer 5633, August 2003, S. 616–620, doi:10.1126/science.1087619, PMID 12893936.
- S. Dang, L. Sun, Y. Huang, F. Lu, Y. Liu, H. Gong, J. Wang, N. Yan: Structure of a fucose transporter in an outward-open conformation. In: Nature. Band 467, Nummer 7316, Oktober 2010, S. 734–738, doi:10.1038/nature09406, PMID 20877283.
- A. Carruthers, J. DeZutter, A. Ganguly, S. U. Devaskar: Will the original glucose transporter isoform please stand up! In: American Journal of Physiology-Endocrinology and Metabolism. Band 297, Nummer 4, Oktober 2009, S. E836–E848, doi:10.1152/ajpendo.00496.2009, PMID 19690067, PMC 2763785 (freier Volltext) (Review).
- D. Deng, N. Yan: GLUT, SGLT, and SWEET: Structural and mechanistic investigations of the glucose transporters. In: Protein science : a publication of the Protein Society. Band 25, Nummer 3, März 2016, S. 546–558, doi:10.1002/pro.2858, PMID 26650681, PMC 4815417 (freier Volltext) (Review).
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemistry. 5. Auflage. Freeman, New York 2002, ISBN 0-7167-4684-0, online verfügbar beim NCBI Bookshelf.
- Donald Voet, Judith G. Voet: Biochemistry. 3. Auflage, John Wiley & Sons, New York 2004. ISBN 0-471-19350-X.