Titin
Titin (auch Connectin) ist ein etwa 3,6 Megadalton schweres, elastisches Protein, welches sich zu Filamenten (Proteinfäden) zusammensetzt. Das humane Titin besteht aus ca. 34.000 Aminosäuren[1] und hat 320 Proteindomänen und ist damit das größte bekannte menschliche Protein.[2] Es ist ein Teil des Sarkomers, der kleinsten funktionellen Einheit in der quergestreiften Muskulatur. Die Aufgabe des Titins im Sarkomer ist, die Myosinköpfe zwischen den Aktinfilamenten zu zentrieren und den kontraktilen Apparat nach der Dehnung zurückzustellen. Anschaulich beschrieben wirkt es wie ein großes Gummiband in unseren Muskeln.
| Titin | ||
|---|---|---|
 | ||
| Struktur nach PDB 1bpv | ||
|
Vorhandene Strukturdaten: 1bpv, 1g1c, 1h8b, 1nct, 1ncu, 1tit, 1tiu, 1tki, 1tnm, 1tnn, 1waa, 1ya5, 2a38, 2bk8, 2f8v, 2ill, 2nzi, 3lpw, 3puc, 3q5o, 3qp3, 3knb | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 34350 aa | |
| Isoformen | 8 | |
| Bezeichner | ||
| Gen-Name | TTN | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.7.11.1, Transferasen | |
| Vorkommen | ||
| Übergeordnetes Taxon | Euteleostomi | |
| Orthologe | ||
| Mensch | Maus | |
| Entrez | 7273 | 22138 |
| Ensembl | ENSG00000155657 | ENSMUSG00000051747 |
| UniProt | Q8WZ42 | |
| Refseq (mRNA) | NM_003319 | NM_011652 |
| Refseq (Protein) | NP_003310 | NP_035782 |
| Genlocus | Chr 2: 178.52 – 178.81 Mb | Chr 2: 76.51 – 76.64 Mb |
| PubMed-Suche | 7273 | 22138 |
Vorkommen
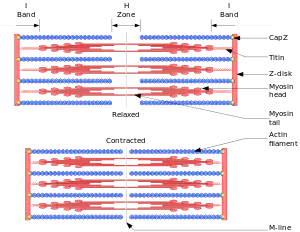
Das Titinfilament ist gemeinsam mit dem Aktinfilament über Alpha-Aktinin mit der Z-Scheibe mechanisch verbunden. Diese Bindung ist relativ schwach und gut regulierbar, eine notwendige Voraussetzung für den ungehinderten Kontraktionsvorgang. Zusätzlich bindet es im Bereich der Z-Scheibe an Telethonin (T-Cap). Im Bereich des A-Bandes ist es mit seinem steifen Carboxylende mit der M-Scheibe verbunden.[3]
Im Bereich des I-Bandes ist das lange Polypeptid elastisch und kann gedehnt werden. Der Aufbau des Titin unterscheidet sich in Skelett- und Herzmuskulatur, womit die geringere Dehnbarkeit des kardialen Sarkomers erklärt werden kann.
An der Muskelkontraktion ist das Titinfilament nicht beteiligt, es sorgt für die Elastizität und Stabilität des Muskels und bestimmt die Kontraktionsgeschwindigkeit in wesentlichem Maße mit. Außerdem ist das Titin verantwortlich für die Ruhespannung des Muskels und wird daher auch oft in Diskussionen um Sinn oder Unsinn des Dehnens angeführt.
Geschichte
Während des größten Teils des vergangenen Jahrhunderts war die Existenz von Titin, dem größten Protein im menschlichen Körper, unbekannt, obwohl es nach heutigen Erkenntnissen das dritthäufigste Muskeleiweiß nach Myosin und Aktin ist. Berechnungen ergeben, dass es bei einem erwachsenen Mann 400 Gramm des Körpergewichts ausmacht. Die Theorien zur Muskelkontraktion basierten auf den damals bekannten Molekülen, insbesondere auf Aktin und Myosin. Es dauerte mehrere Jahrzehnte, bis das Vorhandensein von Titin im Sarkomer allgemein akzeptiert wurde.
Die Geschichte von Titin begann Ende der siebziger Jahre. 1977 isolierten Koscak Maruyama und Mitarbeiter ein elastisches Protein aus Muskelfasern, das sie Connectin nannten.[4] Es stellte sich heraus, dass dieses Protein größer ist als alle bislang bekannten Muskeleiweiße. Paradoxerweise wurde es gerade auf Grund seiner Größe lange Zeit übersehen: Das Protein hat in den üblichen Gel-Elektrophoresen eine zu geringe Mobilität und kann nicht nachgewiesen werden; erst wenn man extrem dünne Gele verwendet, wird es auf dem Gel sichtbar.
Zwei Jahre später identifizierten Kuan Wang und Mitarbeiter auf einem Elektrophoresegel eine Dublettenbande, die einem hochmolekularen, elastischen Protein entsprach, das sie Titin nannten.[5][6]
Siegfried Labeit isolierte 1990 einen partiellen cDNA-Klon von Titin. 1995 bestimmten Labeit und Bernhard Kolmerer die cDNA-Sequenz des menschlichen kardialen Titins und zeigten, dass in verschiedenen Muskeln Isoformen des Protein existieren, die sich erheblich in ihrer Größe unterscheiden. So besitzt die kardiale Titinisoform eine Masse von ungefähr 3 MDa, während das Titin des Musculus soleus ungefähr 3,7 MDa aufweist. Dieser enorme Größenunterschied basiert auf unterschiedlich langen I-Band-Titin-Bereichen dieser Muskeln. Labeit und Kollegen bestimmten 2001 die vollständige Sequenz des menschlichen Titin-Gens.
Genomik
Das menschliche Gen, das für Titin kodiert, befindet sich auf dem langen Arm von Chromosom 2 und enthält 363 Exons, die zusammen für 38.138 Reste (4200 kDa) kodieren. Innerhalb des Gens befindet sich eine große Anzahl von PEVK-Exons (Prolin-Glutamat-Valin-Lysin – reiche Exons) mit einer Länge von 84 bis 99 Nukleotiden, die für konservierte 28- bis 33 Restmotive kodieren, die Struktureinheiten der Titin-PEVK-Feder darstellen können. Die Anzahl der PEVK-Motive im Titin-Gen scheint im Laufe der Evolution zugenommen zu haben, wodurch sich offenbar die genomische Region, die für die Eigenschaften der Titin-Feder verantwortlich ist, verändert hat.[7]
Literatur
- Franziska Rudolph, Judith Hüttemeister, Katharina da Silva Lopes, René Jüttner, Lily Yu, Nora Bergmann, Dhana Friedrich, Stephan Preibisch, Eva Wagner, Stephan E Lehnart, Carol C Gregorio, Michael Gotthardt: Resolving titin’s lifecycle and the spatial organization of protein turnover in mouse cardiomyocytes. In: PNAS. Band 116, Nr. 50, 2019, S. 25126–25136. (Abstract)
Weblinks
Einzelnachweise
- ProtParam: TITIN_HUMAN (Q8WZ42), web.expasy.org, abgerufen am 17. März 2018.
- Dementsprechend wurde es nach den Titanen, den Riesen aus der griechischen Mythologie benannt.
- Stefan Silbernagel, Agamemnon Despopoulos: Taschenatlas Physiologie. 8. Auflage. Thieme, Stuttgart 2012, ISBN 978-3-13-567708-8, S. 64.
- K. Maruyama, S. Matsubara, R. Natori, Y. Nonomura, S. Kimura: Connectin, an elastic protein of muscle. Characterization and Function. In: Journal of Biochemistry. Band 82, Nr. 2, August 1977, S. 317–337, PMID 914784 (oxfordjournals.org).
- K. Wang, J. McClure, A. Tu: Titin: major myofibrillar components of striated muscle. In: Proceedings of the National Academy of Sciences of the United States of America. Band 76, Nr. 8, August 1979, S. 3698–3702. PMID 291034, PMC 383900 (freier Volltext), doi:10.1073/pnas.76.8.3698
- K. Maruyama: Connectin, an elastic protein of striated muscle. In: Biophysical Chemistry. Band 50, Nr. 1–2, Mai 1994, S. 73–85. PMID 8011942, doi:10.1016/0301-4622(94)85021-6
- M. L. Bang, T. Centner, F. Fornoff, A. J. Geach, M. Gotthardt, M. McNabb, C. C. Witt, D. Labeit, C. C. Gregorio, H. Granzier, S. Labeit: The complete gene sequence of titin, expression of an unusual approximately 700-kDa titin isoform, and its interaction with obscurin identify a novel Z-line to I-band linking system. In: Circulation Research. Band 89, Nr. 11, November 2001, S. 1065–1072. doi:10.1161/hh2301.100981. PMID 11717165