Tetramere Proteine
Ein tetrameres Protein ist ein Protein, das sich aus vier Untereinheiten zusammensetzt. Es kann unterteilt werden in Homotetramere, bei denen alle Protein-Untereinheiten identisch sind (beispielsweise bei Glutathion-S-Transferase oder Einzelstrang-bindenden Proteinen), Dimere von Hetero-Dimeren (wie Hämoglobin) und Heterotetramere, bei denen sich alle Untereinheiten voneinander unterscheiden.
Interaktionen der Untereinheiten in tetrameren Proteinen
Die Wechselwirkungen zwischen den Untereinheiten von tetrameren Proteinen sind meist nicht-kovalenter Art,[1] in erster Linie hydrophobe Effekte, Wasserstoffbrückenbindungen und elektrostatische Wechselwirkungen. Bei Proteinen wie der Sorbitdehydrogenase (SDH) wird eine evolutionäre Entwicklung aus einem Monomer über ein Dimer bis hin zum heutigen Tetramer vermutet. Die Bindung der Untereinheiten in tetrameren Proteinen wird durch einen Gewinn an Gibbs-Energie getrieben, welche über die Dissoziationskonstante errechnet werden kann.[1] Diese Zusammenlagerung von vier Untereinheiten A, B, C und D wird in der folgenden Abbildung am Beispiel von SDH gezeigt:
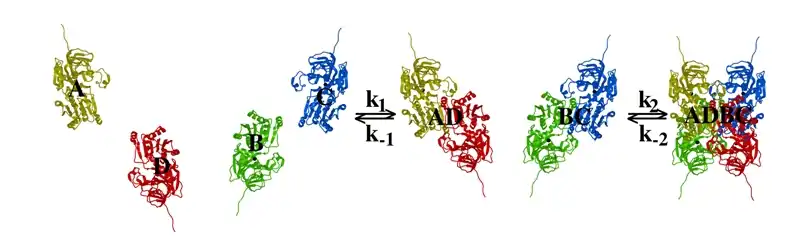
Wasserstoffbrückenbindungen zwischen Untereinheiten
Netzwerke aus Wasserstoffbrückenbindungen zwischen Untereinheiten haben sich als wichtig für die Stabilität der Quartärstruktur erwiesen. Dies wurde in einer Studie an (Säugetier-)SDH unter Nutzung von Sequenz- und Strukturvergleiche, Energieberechnungen, Gelfiltration und Enzymkinetik verdeutlicht.[1]
Einzelnachweise
- M. Hellgren, C. Kaiser, S. de Haij, A. Norberg, J.O. Höög: A hydrogen-bonding network in mammalian sorbitol dehydrogenase stabilizes the tetrameric state and is essential for the catalytic power.. In: Cell. Mol. Life Sci. (CMLS). 64, Nr. 23, 2007, S. 3129–3138. doi:10.1007/s00018-007-7318-1. PMID 17952367.