Schwerionentherapie
Die Schwerionentherapie ist eine Form externer Strahlentherapie und erreicht für besonders strahlenresistente Tumorformen größere Heilungschancen als andere Therapien. Der Tumor wird mit einem Strahl aus Kohlenstoff-Ionen bestrahlt, um die veränderten Zellen abzutöten.


Als erweiterte Form der Protonentherapie gehört die Methode zur Partikeltherapie. Sie wurde am GSI Helmholtzzentrum für Schwerionenforschung in Darmstadt entwickelt und erprobt und wird seit 2009 am Universitätsklinikum Heidelberg in einem eigenen Therapiezentrum (Heidelberger Ionenstrahl-Therapiezentrum, HIT) angewendet, hauptsächlich gegen Tumoren im Kopfbereich. Eine ähnliche Anlage ging im Oktober 2015 im Marburger Ionenstrahl-Therapiezentrum in Betrieb.
Geschichte
Nach vorangegangenen zehn Jahren Grundlagenforschung in Strahlenbiologie und Physik wurde am GSI-Schwerionenbeschleuniger SIS von 1986 bis 1991 der Prototyp einer intensitätsmodulierten Rasterbestrahlung aufgebaut und erprobt. Von 1993 bis 1997 wurde eine Therapie-Einheit aufgebaut. Forschungen zeigten, dass Kohlenstoffionen der ideale Kandidat zur Behandlung tiefliegender Tumoren sind, denn sie bieten eine hohe Dosis am Strahlenende, d. h. einen sehr ausgeprägten Bragg-Peak bei minimalen Streuverlusten im davor gelegenen gesunden Gewebe. Hinzu kommen eine gegenüber Protonen höhere biologische Wirksamkeit auf Tumoren und ein besonderer Nebeneffekt: der Kohlenstoffstrahl erlaubt eine genaue Strahllokalisierung durch entstehende Kohlenstoff-Isotope, deren Emissionen in einer Positronen-Emissions-Tomografie (PET) als Sicherheitskontrolle und Nachweismonitor dienen. Damit konnte in kürzester Zeit nach einer Testphase am 13. Dezember 1997 der erste Patient behandelt werden. Dies war die erste Tumortherapie mit Kohlenstoffionen in Europa und die erste angewandte intensitätsmodulierte Schwerionentherapie weltweit.
Funktionsweise
Bei der Bestrahlungsplanung bestimmt der Strahlentherapeut ausgehend von einer Röntgen-Computertomographie das Zielvolumen, also den Tumor plus einen Sicherheitsabstand. Die gewünschte Dosisverteilung berücksichtigt besonders strahlenempfindliche Risikoorgane wie etwa das Rückenmark. Zur Bestrahlung wird das Zielvolumen rechnerisch in Schichten gleicher Dicke, die quer zur geplanten Strahlrichtung liegen, aufgeteilt. Diese Schichten werden dann vom Ionenstrahl Punkt für Punkt mit genau definierter Energie und Verweildauer abgetastet, so dass jeder Punkt eine vorherberechnete Strahlendosis erhält. Dazu werden die im Beschleunigerring umlaufenden Teilchen so in ihrer Bahn gestört, dass ein Teil von ihnen aus dem Ring austritt und auf das Ziel gelenkt werden kann; die übrigen Teilchen bleiben zunächst im Ring. Die Anzahl der pro Rasterpunkt eingestrahlten Teilchen wird mittels Vieldrahtkammern kontrolliert.
Der Strahleneingang im Patientenraum verläuft horizontal und war zunächst nicht beweglich. Seit Oktober 2012 ist am HIT jedoch die Gantry in Betrieb, eine um 360° drehbare Strahlführung. Die Ablenkung des Strahls zum Abtasten des Zielvolumens wird durch zwei Dipolmagnete erreicht. Mit Kollimatoren wird der Strahl genau eingegrenzt. Durch Drehung des Patiententisches kann der Patient aus wechselnden Richtungen bestrahlt werden.
Vorteile
Gezieltere Energieabgabe
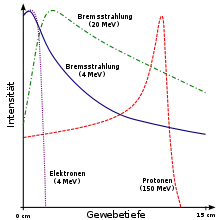
Die Therapie mit Ionen und besonders mit Schwerionen hat gegenüber der herkömmlichen Strahlentherapie mit Photonen (Röntgenstrahlung) den Vorteil, dass die räumliche Energieabgabe der Teilchen sehr viel besser gesteuert werden kann. Photonenstrahlung gibt einen Großteil ihrer Energie direkt beim Eintritt in das Gewebe ab, der Tumor wird vom davor liegenden Gewebe abgeschirmt und erhält eine wesentlich geringere Strahlendosis, während das gesunde Gewebe geschädigt wird. Protonen und, noch ausgeprägter, Schwerionen geben dagegen anfänglich (bei hoher Geschwindigkeit) nur sehr wenig Energie an das umgebende Gewebe ab; ihre Energieabgabe pro Weglänge steigt erst bei geringer Restenergie sehr stark an. Dieser Bereich der Teilchenbahn, der Bragg-Peak, kann nach Vermessung des Tumors durch Wahl der Einfallsenergie der Teilchen so gelegt werden, dass der größte Teil der Energie an den Tumor abgegeben wird, während das gesunde Gewebe kaum geschädigt wird.
Direkte Strahlüberwachung
Auf ihrem Weg durch das Gewebe werden einige Kohlenstoffionen in leichtere Kohlenstoffisotope umgewandelt, die Positronen emittieren. Treffen diese Positronen auf Elektronen, emittieren sie zwei charakteristische Photonen unter einem Winkel von 180°. Auf ihrem Weg in den Körper sorgen einige Teilchen in einem gasdurchflossenen Detektor für eine statistische Ionisation auf einem Metallgitter. Aus den Daten des Detektors lässt sich der Winkel des Strahls und somit dessen Position im Gewebe errechnen und mit den im Therapieplan festgelegten Sollwerten vergleichen und die Ablenkung gegebenenfalls korrigieren.
Quellen
- GSI-Broschüre: Ionenstrahlen im Kampf gegen Krebs
- Webseite des Heidelberger Ionenstrahltherapiezentrums
- Tumortherapie mit schweren Ionen: Grundlagen, Technische Realisierung, Klinische Ergebnisse; Broschüre, 2. Auflage, Februar 2008, ISBN 978-3-9811298-4-7, Hrg. GSI und Verein zur Förderung der Tumortherapie mit schweren Ionen e.V. (PDF-Datei; 3,75 MB)
- Auszug aus GSI-Broschüre (2008) zur Schwerionentherapie als Webseiten auf Welt der Physik