Reelin
Reelin ist ein Glykoprotein, das im Säugetier-ZNS an der Differenzierung und Migration von Neuronen beteiligt ist.
| Reelin | ||
|---|---|---|
| ||
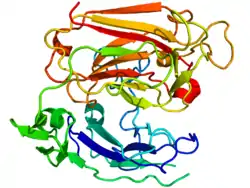
| Bändermodell des Reelin-Fragments aus Maus (AS 1222–1597) nach PDB 2DDU | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 3435 Aminosäuren; 386 kDa | |
| Isoformen | 2 | |
| Bezeichner | ||
| Gen-Namen | RELN ; RL | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.21.-, Serinprotease | |
| Vorkommen | ||
| Übergeordnetes Taxon | Euteleostomi | |
| Orthologe | ||
| Mensch | Maus | |
| Entrez | 5649 | 19699 |
| Ensembl | ENSG00000189056 | ENSMUSG00000042453 |
| UniProt | P78509 | Q148P9 |
| Refseq (mRNA) | NM_005045 | NM_011261 |
| Refseq (Protein) | NP_005036 | NP_035391 |
| Genlocus | Chr 7: 102.9 – 103.42 Mb | Chr 5: 21.4 – 21.86 Mb |
| PubMed-Suche | 5649 | 19699 |
Entscheidende Bedeutung hat es zum Beispiel für die Reifung des Hippocampus, bei dem die scharfe Schichtung verschiedener Neurone essentiell für dessen Funktionalität ist. Dort wird es von Cajal-Rezius-Zellen gebildet. Für Reelin sind bisher zwei Rezeptoren bekannt, die man bisher nur aus dem Lipid-Stoffwechsel kannte. Der eine ist der Apolipoproteinrezeptor 2 (APOER2) und der andere der Rezeptor des Very Low Density Lipoproteins (VLDLR). Über Unterschiede der beiden weiß man noch sehr wenig.
Bei Reelin-Knock-Out-Mäusen (Reeler-Mäuse), zwar lebensfähig, sieht man in Schnitten des Hippocampus und des Neocortex deutlich die ungelenkte Zellmigration, die in Co-Kulturen mit Reelin-produzierenden Hippocampi teilweise wieder gelenkt werden kann.
Klinische Bedeutung
Störungen der Reelin-Verfügbarkeit werden in Zusammenhang gebracht mit folgenden Erkrankungen:
Einzelnachweise
- Lissenzephalie-Syndrom Typ Norman-Roberts. In: Orphanet (Datenbank für seltene Krankheiten).
- K. Ishii, K. I. Kubo, K. Nakajima: Reelin and Neuropsychiatric Disorders. In: Frontiers in cellular neuroscience. Bd. 10, 2016, S. 229, doi:10.3389/fncel.2016.00229, PMID 27803648, PMC 5067484 (freier Volltext) (Review)
- E. Dazzo, M. Fanciulli, E. Serioli, G. Minervini, P. Pulitano, S. Binelli, C. Di Bonaventura, C. Luisi, E. Pasini, S. Striano, P. Striano, G. Coppola, A. Chiavegato, S. Radovic, A. Spadotto, S. Uzzau, A. La Neve, A. T. Giallonardo, O. Mecarelli, S. C. Tosatto, R. Ottman, R. Michelucci, C. Nobile: Heterozygous reelin mutations cause autosomal-dominant lateral temporal epilepsy. In: American Journal of Human Genetics. Bd. 96, Nr. 6, Juni 2015, S. 992–1000, doi:10.1016/j.ajhg.2015.04.020, PMID 26046367, PMC 4457960 (freier Volltext).
- A. Botella-López, F. Burgaya, R. Gavín, M. S. García-Ayllón, E. Gómez-Tortosa, J. Peña-Casanova, J. M. Ureña, J. A. Del Río, R. Blesa, E. Soriano, J. Sáez-Valero: Reelin expression and glycosylation patterns are altered in Alzheimer's disease. In: Proceedings of the National Academy of Sciences. Bd. 103, Nr. 14, April 2006, S. 5573–5578, doi:10.1073/pnas.0601279103, PMID 16567613, PMC 1414634 (freier Volltext).
Literatur
Förster, E. et al. (2006): Laminating the hippocampus. In: Nat. Rev. Neurosci. 7(4):259-267. PMID 16543914 doi:10.1038/nrn1882 PDF