Protactinium(V)-fluorid
Protactinium(V)-fluorid ist eine chemische Verbindung, bestehend aus den Elementen Protactinium und Fluor. Es besitzt die Formel PaF5 und gehört zur Stoffklasse der Fluoride.
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
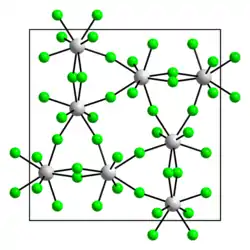 | |||||||
| _ Pa5+ _ F− | |||||||
| Kristallsystem | |||||||
| Raumgruppe |
I42d (Nr. 122) | ||||||
| Gitterparameter |
a = 1153 pm | ||||||
| Allgemeines | |||||||
| Name | Protactinium(V)-fluorid | ||||||
| Andere Namen |
Protactiniumpentafluorid | ||||||
| Verhältnisformel | PaF5 | ||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 307,09 g·mol−1 | ||||||
| Aggregatzustand |
fest[1] | ||||||
| Löslichkeit |
löslich in Wasser und Flusssäure (Dihydrat)[1] | ||||||
| Gefahren- und Sicherheitshinweise | |||||||

Radioaktiv | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Darstellung
Protactinium(V)-fluorid kann durch Reaktion von Protactinium(V)-oxid mit Brom(III)-fluorid oder Brom(V)-fluorid bei 600 °C gewonnen werden.[1]
Ebenfalls möglich ist die Darstellung durch Reaktion von Protactinium(V)-chlorid oder Protactinium(IV)-fluorid mit Fluor bei 700 °C.[1]
Protactinium(V)-fluorid-hydrat kann durch Reaktion von Protactinium(V)-oxid mit wässriger Flusssäure gewonnen werden.[1]
Auch die thermische Zersetzung von Protactinium-Fluor-Komplexen führt teilweise zu Protactinium(V)-fluorid,[3]
Eigenschaften
Protactinium(V)-fluorid ist weißer, flüchtiger, äußerst hygroskopischer Feststoff, der in Wasser teilweise, besser in Flusssäure löslich ist. Es besitzt eine tetragonale Kristallstruktur vom β-Uranpentafluorid-Typ mit der Raumgruppe I42d (Raumgruppen-Nr. 122) mit den Gitterparametern a = 1153 pm, c = 510 pm. Quarz und Pyrex werden bei höherer Temperatur von der Verbindung angegriffen. Als Dihydrat ist sie ein farbloser, hygroskopischer, kristalliner Feststoff von wachsartiger Beschaffenheit, der löslich in Wasser und Flusssäure ist.[1] Mit Phosphortrifluorid reagiert er zu Protactinium(IV)-fluorid.[4] Das Dihydrat kann in Luft, Fluorwasserstoff und Fluor bei niedrigen Temperaturen nicht in das Anhydrat überführt werden. Anstelle dessen entsteht Diprotactinium(V)-oxidoctafluorid Pa2OF8. Bei höheren Temperaturen um 325 °C entsteht eine Mischung von letzterem und Protactinium(V)-fluorid.[3]
Einzelnachweise
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 1170.
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- G. Meyer, Lester R. Morss: Synthesis of Lanthanide and Actinide Compounds. Springer, 1991, S. 77 (eingeschränkte Vorschau in der Google-Buchsuche).
- Lester R. Morss, Norman M. Edelstein, J. Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements (Set Vol. 1–6). Springer, 2010, ISBN 978-94-007-0211-0, S. 198 (eingeschränkte Vorschau in der Google-Buchsuche).