Proanthocyanidine
Proanthocyanidine ist ein Sammelbegriff für farblose, phenolische Naturstoffe, die beim Erhitzen mit verdünnten Mineralsäuren eine Farbreaktion ergeben („Proanthocyanidinreaktion“). Die Farbe entsteht durch die Bildung von Anthocyanidinen, den farbgebenden Komponenten der Anthocyane, die die rote, violette oder blaue Färbung von Blüten, Blättern und Früchten bedingen.
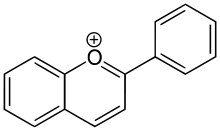
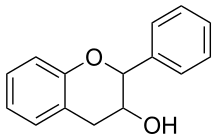
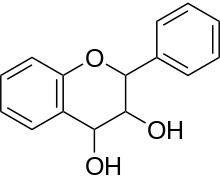
Farbgebendes Strukturelement ist das Flavylium-Kation, ein Chromophor, das bei der Reaktion gebildet wird. Eine positive Reaktion geben nur monomere Flavan-3,4-diole (Leukoanthocyanidine) sowie Flavan-3-ole (Catechine) bzw. deren Di- und Oligomere (kondensierte Gerbstoffe), bei denen das Kohlenstoffatom C-4 der einen Einheit mit dem C-8 der nächsten Einheit verknüpft ist.[1]
Eine Untergruppe der Proanthocyanidine bilden die Procyanidine, die sich ausschließlich aus Catechin- und Epicatechinmonomeren zusammensetzen.[2][1] Sie sind die in der Natur am weitesten verbreitet vorkommenden Proanthocyanidine.[1]
Nach Weinges werden Dimere in eine A- und B-Gruppe unterteilt: Vertreter der B-Gruppe sind über eine C-C-Bindung zwischen dem C-4 der einen mit dem C-6 oder C-8 der nächsten Einheit verknüpft, während die der A-Gruppe eine zusätzliche Etherbindung zwischen dem C-2 der einen und dem Sauerstoff am C-7- oder C-5 der nächsten Einheit aufweisen. Trimere bilde die C-Gruppe, Tetramere die D-Gruppe.[3] Die natürlichen Procyanidine sind (2R)-konfiguriert, sie unterscheiden sich in der Stereochemie an den Positionen C-3 und C-4. Beispiele für einige di- und oligomere Procyanidine sind die in Crataegus-Arten gefundenen Procyanidine B1 [4β→8, (3’S)], B2 [4β→8, (3’R); Hauptkomponente], B4 [4α→8, (3’R)], B5 [4β→6, (3’R)], C1 und D1.[1]
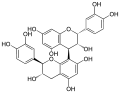 Procyanidin B1
Procyanidin B1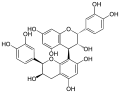 Procyanidin B2
Procyanidin B2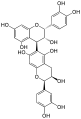 Procyanidin B5
Procyanidin B5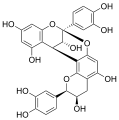 Procyanidin A2
Procyanidin A2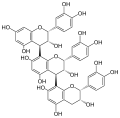 Procyanidin C1 (PCC1)[4]
Procyanidin C1 (PCC1)[4]


In Analogie zu den Procyanidinen werden Strukturvarianten mit abweichender Hydroxylierung als beispielsweise Propelargonidine und Prodelphinidine bezeichnet. Namensgebend ist jeweils das Anthocyanidin, das bei der Spaltung der säurelabilen C-C-Bindung am C-4 entsteht.[3] Die Procyanidine ergeben in der Proanthocyanidinreaktion rote Farbtöne (Cyanidin), die Properlargonidine orangerote und die Prodelphinidine violette bis blaue Farbtöne.[1]
Oligomere Proanthocyanidine (OPC) kommen als Inhaltsstoffe in zahlreichen Pflanzen vor, die als Nahrungs-, Genuss- und Arzneimittel eine Rolle spielen. Sie sind wasser- und ethanollöslich, was für die Herstellung von Pflanzenextrakten bedeutsam ist. Ab einem Polymerisationsgrad von 8 entsprechend einer Molmasse von circa 3000 Dalton spricht man häufig von polymeren Proanthocyanidinen (PPC), die zunehmend schlechter wasserlöslich sind. Höher kondensierte, wasserunlösliche Verbindungen werden Phlobaphene genannt, sie geben keine positive Proanthocyanidinreaktion.[5]
Weblinks
- Proanthocyanidine im Pschyrembel
- Proanthocyanidine auf Spektrum.de
Einzelnachweise
- R. Hänsel, O. Sticher: Pharmakognosie – Phytopharmazie, 8. Auflage, Springer 2007, S. 1190, 1201 ff.
- T. Dingermann, K. Hiller, G. Schneider, I. Zündorf: Schneider Arzneidrogen. 5. Auflage. Elsevier, 2004, ISBN 3-8274-1481-4, S. 306 f.
- Frank Petereit, Adolf Nahrstedt: Inhaltsstoffe offizineller Weißdorn-Drogen: Crataegus aus analytischer Sicht. In: Pharmazie in unserer Zeit. Band 34, Nr. 1, 2005, S. 22–26, doi:10.1002/pauz.200400100.
- Carissa Wong: Grape seed chemical allows mice to live longer by killing aged cells, auf: NewScientist vom 6. Dezember 2021
- R. Hänsel, O. Sticher: Pharmakognosie – Phytopharmazie, 8. Auflage, Springer 2007, S. 1249 f., 1253.