Polybromierte Dibenzodioxine und Dibenzofurane
Polybromierte Dibenzodioxine und Dibenzofurane (abgekürzt PBDD/PBDF) sind eine Gruppe von Chemikalien, die den polychlorierten Dibenzodioxinen und -furanen sowohl in ihren chemischen Strukturen als auch in ihrer Wirkung entsprechen. Sie entstehen durch die Verbrennung verbleiten Benzins oder durch die thermische Zersetzung von Kunststoffen, die bromierte Flammschutzmittel enthalten.
Entstehung
Die Müllverbrennung gilt als der Haupteintragspfad in die Umwelt. In der Flugasche von Müllverbrennungsanlagen beträgt die Menge der bromhaltigen PBDD/PBDF nur einige Prozent der chlorierten Dioxine und Furane. Das lässt sich damit erklären, dass Hausmüll wesentlich mehr Chlor als Brom enthält, der Bromgehalt liegt zwischen 1 und 4 % des Chlorgehalts. Der Hauptanteil davon geht auf Kunststoffe zurück, die bromierte Flammschutzmittel enthalten.
In bromierten Flammschutzmitteln wie polybromierten Diphenylethern oder Biphenylen, Tetrabrombisphenol A und Hexabromcyclododecan können bereits von Haus aus geringe Rückstände von PBDD/PBDF enthalten sein. In der Produktion werden die Flammschutzmittel den Kunststoffen bei etwa 300 °C im Extruder beigemischt. Dieses Verfahren führt bereits zu einem starken Anstieg der PBDD/PBDF-Gehalte. Bei Bränden, beim Verbrennen flammgeschützter Kunststoffe in Müllverbrennungsanlagen oder der Pyrolyse können nochmals erhebliche Mengen PBDD/PBDF entstehen. Bei den betrachteten Entstehungswegen werden weit mehr polybromierte Dibenzofurane als Dibenzodioxine gebildet.
| Art der Probe | Herstellung | Br4DF | Br5DF | Br6DF | Br7DF | Br8DF |
|---|---|---|---|---|---|---|
| technisches DecaBDE | kommerziell | n.n. | n.n. | 2,3 | 250 | 34 |
| Flammschutzmittel-Formulierung mit DecaBDE | bei 150 °C | 23 | 107 | 3470 | 2700 | 580 |
| PBT-Plastik | Extruder, 250 °C | 14–26 | 65–109 | 230–250 | 500–980 | 410–1600 |
| PBT-Plastik | Pyrolyse, 400 °C, 10 min | 1.405.000 | 1.101.000 | 252.000 | 43.000 | 2800 |
Polybromierte Diphenylether oder Biphenyle sind direkte Vorläufermoleküle für die Bildung von polybromierten Dibenzofuranen bei Verbrennungsprozessen.
Beim Recycling von Elektroschrott, insbesondere durch das Einschmelzen oder Verschwelen von flammschutzmittelhaltigen Leiterplatten, werden erhebliche Mengen PBDD/PBDF freigesetzt.
Verbleites Benzin enthielt die Scavenger 1,2-Dichlorethan und 1,2-Dibromethan, aus denen bei der Verbrennung polyhalogenierte Dibenzodioxine und Dibenzofurane (PXDD/PXDF) entstanden. Im Abgas waren die Gehalte der bromierten oder gemischthalogenierten Dioxin-Kongenere vergleichbar oder höher als die der chlorierten Kongenere.[2]
| Substanzen | Verbleites Benzin | Unverbleit, ohne Kat | Unverbleit, mit Kat |
|---|---|---|---|
| Cl1–Cl3-PCDD | 45.000 | 4970 | 12 |
| Br1–Br3-PBDD | 117.500 | 5090 | 13 |
| Cl4–Cl8-PCDD | 11.492 | 287 | 37,3 |
| Br4–Br8-PBDD | 1000 | 40 | 4 |
| Cl1–Cl3-PCDF | 1.388.600 | 17.840 | 259 |
| Br1–Br3-PBDF | 3.214.400 | 12.930 | 232 |
| Cl4–Cl8-PCDF | 9733 | 478 | 25,1 |
| Br4–Br8-PBDF | 14.200 | 100 | 46 |
Toxikologie
Bromierte Dibenzodioxine und Dibenzofurane sind etwa so toxisch wie ihre chlorierten Analoga.[4] Daten zur Toxikologie bromierter und bromiert/chlorierter Dioxine und Furane liegen nur in unzureichendem Maß vor. Es scheint allerdings gesichert zu sein, dass die an 2,3,7,8-Position bromierten Kongenere die stärkste Giftwirkung haben. PBDD/PBDF werden in dem System der Toxizitätsäquivalente nicht berücksichtigt, allerdings gibt es in der Literatur Angaben zu ihrer „Relativen Potenz“ im Verhältnis zu 2,3,7,8-TCDD, also eine Art vorläufiges Toxizitätsäquivalent. Die Toxizität bromierter Furane scheint noch höher zu sein als die ihrer chlorierten Gegenstücke.[5]
| Substanzen | REP |
|---|---|
| 2,3,7,8-TBDD | 0,65 oder 0,75 |
| 1,3,7,8-TBDD | 0,013 |
| 1,2,3,7,8-PBDD | 0,3 |
| 1,2,3,7,8,9-HxBDD | 0,03 |
| 2,3,7,8-TBDF | 0,7 oder 0,79 |
| 1,2,3,7,8-PBDF | 0,5 |
| 2,3,4,7,8-PBDF | 0,21 oder 0,52 |
| 1,2,3,4,7,8-HxBDF | 0,002 |
| 2monoBr-378tri-CDD | 0,94 |
| 23diBr-78diCDD | 0,69 |
| 37diBr-28diCDD | 0,96 oder 0,68 |
| 1monoBr-2378tetraCDD | 0,60 oder 0,32 |
| 2monoBr-36789pentaCDD | 0,19 |
In Deutschland wurden 1993 mit der Dioxin-Verordnung erstmals Grenzwerte für acht bromierte Dioxine und Furane festgelegt.[6]
Sonstiges
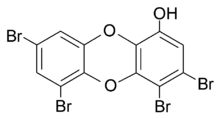
Das von dem Meeresschwamm Dysidea dendyi produzierte Spongiadioxin A stellt die polybromierte Verbindung 1-Hydroxy-3,4,6,8-tetrabromdibenzo[1,4]dioxin dar.[7][8]
Aus in Lösungsmitteln gelösten PBDD/PBDF werden unter UV-Licht innerhalb von Minuten Bromatome abgespalten (Photolyse). Die Standardlösungen für die Analytik bromierter Dioxine und Furane müssen daher lichtgeschützt aufbewahrt werden. In der Atmosphäre ist eine rasche Photolyse nur für den relativ kleinen Anteil der gasförmig vorliegenden PBDD/PBDF zu erwarten, nicht für die partikelgebundenen.
Das 2,3,7,8-Tetrabromdibenzofuran wurde bereits 1941 als erstes „Dioxin“ von einem japanischen Wissenschaftler bei der Untersuchung von Derivaten des Biphenylen-Oxids entdeckt.[2]
Einzelnachweise
- Donnelly et al.: Analysis of thermoplastic resins for brominated dibenzofurans. Biomed. Environ. Mass. Spectrom. 18:884–896 (1989), doi:10.1002/bms.1200181008; zitiert nach Ballschmiter und Bacher (1996).
- Karlheinz Ballschmiter, Reiner Bacher: Dioxine. Verlag Chemie (VCH), Weinheim 1996, ISBN 3-527-28768-X.
- Hagenmaier et al.: Emissions of polyhalogenated dibenzodioxins and dibenzofurans from combustion engines. Organohalogen Compounds 2:329–334 (1990), zitiert nach Ballschmiter und Bacher (1996).
- Dieter Lenoir, Stefan Leichsenring: Konzepte und Methoden des Umweltschutzes: das Beispiel Dioxine. Chemie in unserer Zeit 30(4), S. 182–191 (1996), doi:10.1002/ciuz.19960300404.
- E. Eljarrat, D. Barceló: Toxicity Potency Assessment of Persistent Organic Pollutants in Sediments and Sludges in D. Barceló: Emerging Organic Pollutants in Waste Waters and Sludge, The Handbook of Environmental Chemistry, Vol. 5 Part 1, Springer Verlag, Berlin, 2004, S. 99–140, ISBN 3-540-21365-1.
- Umweltbundesamt Berlin: Dioxine, abger. 19. August 2007.
- Gordon W. Gribble: Umweltgifte vom Gabentisch der Natur (Memento vom 26. Januar 2009 im Internet Archive) (PDF; 416 kB). Spektrum der Wissenschaft, Juni 2005, S. 38ff.
- Karsten Strey: Die Welt der Gifte. ISBN 3865414192, S. 254 (eingeschränkte Vorschau in der Google-Buchsuche).