Peptidyl-Prolyl-cis-trans-Isomerasen
Peptidyl-Prolyl-cis-trans-Isomerasen (auch PPIasen oder PPI) sind Enzyme, die in allen Lebewesen vorkommen. Sie katalysieren die Bindungsachsenrotation von Amid-Bindungen in Proteinen, an denen die Aminosäure Prolin beteiligt ist. Diese Reaktion ist der geschwindigkeitsbestimmende Schritt bei der Proteinfaltung. Beim Menschen sind mindestens 33 verschiedene PPIasen bekannt, von denen bereits mehrere das Target pharmazeutischer Wirkstoffe sind.[2]
| Peptidyl-Prolyl-cis-trans-Isomerasen | ||
|---|---|---|
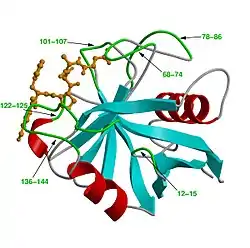 | ||
| Bändermodell von Cyclophilin A (Mensch) mit Peptidsubstrat (orange), nach PDB 1RMH | ||
| Enzymklassifikation | ||
| EC, Kategorie | 5.2.1.8, Isomerase | |
| Reaktionsart | Rotation einer Amidbindung | |
| Substrat | Peptidylprolin (Ω=180°) | |
| Produkte | Peptidylprolin (Ω=0°) | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen[1] | |
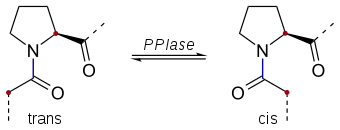
PPIasen werden in drei Klassen eingeteilt: Cyclophiline, FK506-bindende Proteine und Parvuline.[3]
Proteinfaltung
Die Planarität der Peptidbindung zwingt den ω-Winkel normalerweise auf 180° (die häufige trans-Konformation) oder 0° (die seltene cis-Konformation). Die cis-Konformation ist hauptsächlich zu beobachten, wenn Prolin an einer Peptidbindung beteiligt ist. Diese Bindung kann sowohl in der trans- als auch in der cis-Konfiguration vorliegen, ein Wechsel zwischen beiden Konfigurationen findet nur langsam statt. Dies hängt mit der cyclischen Struktur des Prolin-Moleküls zusammen, bei der die Aminogruppe neben dem zentralen C-Atom (α-C-Atom) auch mit der Seitenkette der Aminosäure verbunden ist, was bei keiner weiteren proteinogenen Aminosäure der Fall ist.
Die spezifische Proteinfaltung (Ausbildung der dreidimensionalen Struktur) von solchen Proteinen, die unter anderem von den räumlichen Strukturen der einzelnen Bindungen abhängt, kann daher nicht selbständig spontan ablaufen. Die Peptidyl-Prolyl-cis-trans-Isomerasen wirken hier als Faltungshelfer. Die Enzyme sind in der Lage, zwischen der cis- und der trans-Konfiguration der jeweiligen Peptidbindung zu schalten, so dass sich das Protein korrekt falten und erst dann seine Funktion erfüllen kann. Dabei können sowohl cis- als auch trans-Konfigurationen entstehen.[4]
Einzelnachweise
- Suchergebnis EC:5.2.1.8 bei UniProt.
- Suchergebnis EC:5.2.1.8 (Mensch) bei UniProt.
- Natalya K. Nagradova: Foldases: enzymes catalyzing protein folding. Nova Biomedical Books, New York 2008, ISBN 1-60456-389-3, S. 51 ff.
- Arthur Greenberg, Curt M. Breneman, Jeffrey M. Liebman: The amide linkage: structural significance in chemistry, biochemistry and materials science. Wiley, New York 2003, ISBN 0-471-42025-5, S. 75 ff.