Oxyanion-Loch
Das Oxyanion-Loch ist eine Form des aktiven Zentrums von Enzymen, in der ein negativ geladener Sauerstoff (ein Oxyanion) gebunden und stabilisiert wird. Das Oxyanion-Loch kommt in manchen Dehydrogenasen (in der Mannitol-2-Dehydrogenase aus Pseudomonas fluorescens)[1] und einigen Esterasen vor, darunter unter anderem in Serinproteasen,[2] Cysteinproteasen,[2] Lipasen[3][4] und Acyltransferasen.[5] Das Oxyanion-Loch bildet im aktiven Zentrum eine passende Lücke und stabilisiert im Verlauf einer enzymatischen Katalyse die negativ geladene (anionische) Form des Sauerstoffs (Oxy), welches hier den Übergangszustand des Substrats darstellt. Entsprechend wird bei der Katalyse die Aktivierungsenergie der Reaktion gesenkt.
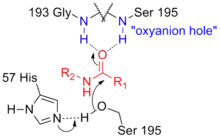
Im Zuge des Proteindesigns wurde das Oxyanion-Loch verändert, um eine Protease zur Proteinligation zu verwenden.[6]
Literatur
- E. V. Beletskiy, J. Schmidt, X. B. Wang, S. R. Kass: Three hydrogen bond donor catalysts: oxyanion hole mimics and transition state analogues. In: JACS. Band 134, Nummer 45, November 2012, S. 18534–18537, doi:10.1021/ja3085862, PMID 23113730.
Einzelnachweise
- M. Klimacek, B. Nidetzky: The oxyanion hole of Pseudomonas fluorescens mannitol 2-dehydrogenase: a novel structural motif for electrostatic stabilization in alcohol dehydrogenase active sites. In: Biochemical Journal. Band 425, Nummer 2, Januar 2010, S. 455–463, doi:10.1042/BJ20091441, PMID 19857201.
- R. Ménard, A. C. Storer: Oxyanion hole interactions in serine and cysteine proteases. In: Biological Chemistry Hoppe-Seyler. Band 373, Nummer 7, Juli 1992, S. 393–400, PMID 1387535.
- S. Canaan, A. Roussel, R. Verger, C. Cambillau: Gastric lipase: crystal structure and activity. In: Biochimica et Biophysica Acta. Band 1441, Nummer 2–3, November 1999, S. 197–204, PMID 10570247.
- A. Bassegoda, F. I. Pastor, P. Diaz: Rhodococcus sp. strain CR-53 LipR, the first member of a new bacterial lipase family (family X) displaying an unusual Y-type oxyanion hole, similar to the Candida antarctica lipase clan. In: Applied and Environmental Microbiology. Band 78, Nummer 6, März 2012, S. 1724–1732, doi:10.1128/AEM.06332-11, PMID 22226953, PMC 3298128 (freier Volltext).
- C. Milkowski, D. Strack: Serine carboxypeptidase-like acyltransferases. In: Phytochemistry. Band 65, Nummer 5, März 2004, S. 517–524, doi:10.1016/j.phytochem.2003.12.018, PMID 15003414.
- L. Franke, S. Liebscher, F. Bordusa: Engineering the oxyanion hole of trypsin for promoting the reverse of proteolysis. In: Journal of Peptide Science Band 20, Nummer 2, Februar 2014, S. 128–136, doi:10.1002/psc.2597, PMID 24357225.