Oxathiazinondioxide
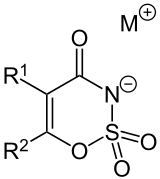
Oxathiazinondioxide gehören zur Gruppe der Oxathiazine, heterocyclische Verbindungen, die im Sechsring neben drei Kohlenstoffatomen jeweils ein Sauerstoff-, Schwefel- und Stickstoffatom enthalten. Der bekannteste Vertreter ist das Kaliumsalz von 6-Methyl-3,4-dihydro-1,2,3-oxathiazin-4-on-2,2-dioxid, das als Süßstoff unter dem Namen Acesulfam-K Verwendung findet. Es gibt eine Vielzahl von Derivaten, die in Position 5 und 6 des Rings unterschiedlich substituierte Alkylgruppen aufweisen. Kationen können Natrium-, Kalium- und Calciumionen sein.
Herstellung
Die klassische Methode ist die Umsetzung von Fluorsulfonisocyanat (OCN-SO2F) mit Butinen, wie 1- oder 2-Butin, oder 1-Hexin und Ringschluss mit Natronlauge. 2-Butin reagiert so zu N-Fluorsulfonyl-α-methylacetessigsäureamid als Zwischenprodukt, das unter Ringschluss 5,6-Dimethyl-3,4-dihydro-1,2,3-oxathiazin-4-on-2,2-dioxid bildet.
Eine weitere Methode ist die Umsetzung von Ketonen mit Fluorsulfonsäureisocyanat. Aus Aceton erhält man so das 6-Methyl-3,4-dihydro-1,2,3-oxathiazin-4-on-2,2-dioxid und aus 2-Butanon das 5,6-Dimethyl-3,4-dihydro-1,2,3-oxathiazin-4-on-2,2-dioxid.
Eigenschaften
Alle Oxathiazinondioxide sind thermisch und chemisch stabile Verbindungen. Sie bilden mit Alkalimetallionen und Calciumionen stabile Salze, die einen Schmelzpunkt über 200 °C haben und je nach Substituenten eine unterschiedliche Löslichkeit in Wasser aufweisen. Alle Verbindungen sind ungiftig. Alle Derivate sind Süßstoffe, wobei das Natriumsalz von 5-Ethyl-6-methyl-3,4-dihydro-1,2,3-oxathiazin-4-on-2,2-dioxid die höchste (250) und das unsubstituierte 3,4-Dihydro-1,2,3-oxathiazin-4-on-2,2-dioxid die geringste (10) Süßkraft hat.
Literatur
- Karl Clauß, Harald Jensen: Oxathiazinondioxide, eine neue Gruppe von Süßstoffen. In: Angewandte Chemie. Bd. 85, Nr. 22, 1973, S. 965–973, doi:10.1002/ange.19730852202