OB-Faltung
Die OB-Faltung (engl.: OB-fold) bezeichnet eine Art der Proteinfaltung (Proteinstruktur). Das Akronym leitet sich her von Oligonucleotide/Oligosaccharide Binding.[1]
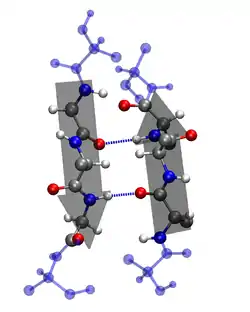
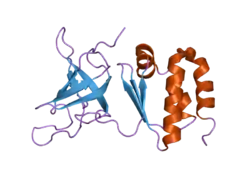
Diese sterische Proteinstruktur findet sich beispielsweise in Zellwänden und dient zur molekülspezifischen Interaktion, im weiteren Sinn zum Stoffwechsel und Informationsaustausch lebender Zellen.
Die OB-Faltung besteht aus fünf β-Faltblättern, die im Kreis angeordnet sind und so eine fassförmige Tertiärstruktur bilden, ein sogenanntes Beta-Barrel (β-barrel).[2][3] OB-Faltungen wurden in verschiedenen Proteinen wie z. B. Nucleasen und Synthetasen nachgewiesen und zeichnen sich untereinander durch eine geringe Sequenzhomologie, aber durch eine hohe Strukturhomologie aus. Dies bedeutet, dass sich die Aminosäuren-Abfolgen verschiedener OB-Faltungen stark voneinander unterscheiden können, sie aber dennoch eine ähnliche räumliche Struktur aufweisen.[4][5]
Einzelnachweise
- V. Agrawal, K. V. Kishan: OB-fold: growing bigger with functional consistency. In: Curr Protein Pept Sci. 4(3), Jun 2003, S. 195–206.
- Biocompare: Cytosolic Expression Of Green Fluorescent Protein (GFP) And Its Derivatives In The Yeast Saccharomyces Cerevisiae: Detection In Vivo Using The Varian Cary Eclipse.
- Petra Averhoff: Characterization of the specificity of human neutrophil elastase for Shigella flexneri virulence factors. Dissertation. Universität Berlin.
- A. G.Murzin u. a.: OB(oligonucleotide/oligosaccharide binding)-fold: common structural and functional solution for non-homologous sequences. In: EMBO J. Band 12, Nr. 3, März 1993, S. 861–867, PMC 413284 (freier Volltext).
- D. L. Theobald, R. M. Mitton-Fry, D. S. Wuttke: Nucleic acid recognition by OB-fold proteins. In: Annu Rev Biophys Biomol Struct. Band 32, Februar 2003, S. 115–133, doi:10.1146/annurev.biophys.32.110601.142506.