Nonylphenole
Die Nonylphenole (NP) sind eine Mischung aus zahlreichen strukturisomeren und stereoisomeren chemischen Verbindungen. Summenformel (C15H24O) und Molmasse (220,35 Da) der einzelnen Verbindungen sind gleich. Jede einzelne Verbindung bestehend aus einem aromatischen Ring mit Hydroxygruppe sowie einem Alkylrest aus neun Kohlenstoffatomen meist in para-Stellung zur phenolischen Hydroxygruppe. Das Isomer mit linearer Seitenkette wird als n-Nonylphenol bezeichnet und ist industriell nur von untergeordneter Bedeutung. Nonylphenole werden zur Gruppe der langkettigen Alkylphenole – LCAPs (englisch long chain alkyl phenols) – gezählt und kommen nicht natürlich in der Umwelt vor. Aufgrund der östrogen wirkenden, persistenten und toxischen Eigenschaften werden Nonylphenole in der EU-Wasserrahmenrichtlinie zu den prioritär gefährlichen Stoffen gezählt.[1] Im Juni 2013 wurde Nonylphenol, sowohl lineare als auch verzweigtkettige, in die Liste der besorgniserregenden Substanzen der ECHA aufgenommen.[2] Zuvor wurde auf Antrag der Bundesstelle für Chemikalien das Dossier zur Aufnahme in die REACH-Kandidatenliste eingereicht, das NP gemäß Art. 57 (f) kategorisiert.
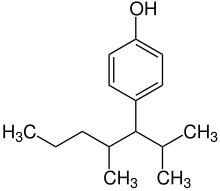
Herstellung
Die Synthese erfolgt katalytisch aus Phenol und Nonen (großtechnisch aus einer Mischung aus Nonenisomeren, die aus Propen trimerisiert werden). Das so entstehende Isomerengemisch besteht aus sehr vielen Isomeren, die unterschiedlich verzweigte Alkylketten aufweisen.[3][4][5] Die handelsübliche Form enthält 85 % para-Nonylphenol, 10 % ortho-Nonylphenol sowie weitere dialkylierte Alkylphenole. Theoretisch sind bis zu 211 Konstitutionsisomere von NP möglich, deren Anzahl mit allen Stereoisomeren auf 550 steigt.[6]
Eigenschaften
Die Nonylphenole sind gelbliche Flüssigkeiten mit schwach phenolartigem Geruch.[7] Ihr Schmelzpunkt liegt bei −8 °C, der Siedebereich zwischen 290 und 320 °C.[7] Die Löslichkeit in Wasser liegt bei 6 mg/100 ml bei 20 °C für NP.[8]
Verwendung
Nonylphenole werden hauptsächlich für die Herstellung von Nonylphenolethoxylaten (NPEO) verwendet, welche als nichtionische Tenside z. B. in Waschlösungen eingesetzt werden. Zudem ist es in Fungiziden, Arzneimitteln, Weichmachern für Celluloseester, Farben und Lacken und in Polymeren oder Klebstoffen enthalten. Die Nonylphenole gehören zu den prioritären Stoffen der Europäischen Union und sind seit Dezember 2003 für bestimmte Verwendungen, bei denen das Stoffgemisch ins Abwasser oder in direkten Kontakt mit dem Menschen kommen kann, nicht mehr zugelassen.[9] Nach einer Untersuchung der schwedischen Naturschutzvereinigung SNF gelangen Nonylphenole auch über importierte Textilien aus Ländern wie China, Indien oder der Türkei in die EU-Länder.[10]
Umweltverhalten
Der Haupteintragsweg in die Umwelt ist die Behandlung von NPEO-belasteten Klärwässern. Das dabei entstehende Nonylphenol ist nicht leicht biologisch abbaubar. Bei der Entfernung aus der Umwelt spielt der mikrobiologische Abbau eine wichtige Rolle. Berechnete Halbwertszeiten liegen bei ungefähr 0,3 Tagen in der Luft und ungefähr 30 Tagen in Wasser und Boden. Auf Grund der hohen Bioakkumulation des NP reichert sich dieses in der Umwelt an. Trotz bisher getroffener Maßnahmen sind Nonylphenole immer noch nachzuweisen und in vielen Matrizes bereits ubiquitär.
Biologische Wirkung
| Vergleich Estradiol mit Nonylphenol (schematische Darstellung) |
|---|
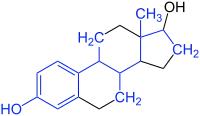 Estradiol |
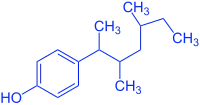 Nonylphenol-Isomer |
Nonylphenole sind als Xenoestrogene hormonell aktive Substanzen und wechselwirken mit dem Estrogenrezeptor. So kann dies z. B. bei männlichen Jungfischen die nur für weibliche Fische relevante Vitellogenin-Synthese auslösen. In diversen in-vivo- und in-vitro-Studien konnte die Östrogenität gezeigt werden, wobei die Östrogenität der jeweiligen Nonylphenolisomere sich erheblich unterscheidet.[11][12][13]
Bei der Betrachtung der östrogenen Aktivität ist eine isomerenspezifische Sichtweise daher von großer Bedeutung. Die östrogene Wirkung wird dabei sehr stark durch die Verzweigung der Nonylseitenkette beeinflusst.[14][15] Auch enantioselektive Aspekte spielen eine Rolle.[16][17] In Untersuchungen konnte gezeigt werden, dass (S)- und (R)-Enantiomere ein unterschiedliches östrogenes Potenzial aufweisen.[18]
Auf viele Organismen wirken die Nonylphenole toxisch – beispielsweise auf zahlreiche Fischarten (z. B. Seelachs) sowie Süßwassermuschel, Wasserfloh, Grünalge, Krabbe oder Hummer. Die LD50-Werte liegen in der Größenordnung von 0,1–1 mg/l. Wie australische Ökologen um Ashley Ward von der University of Sydney herausfanden, beeinflussen Nonylphenole das kohäsive Verhalten von Fischen.[19] Bereits geringe Mengen von nur 0,5 Mikrogramm Nonylphenolen reichen, um den Eigengeruch der Fische zu überdecken, was dazu führt, dass sie größeren Abstand zueinander einhalten.[20]
Das dänische Institut für Sicherheit und Toxikologie berechnete einen vorläufigen TDI-Wert von 5 µg/Tag/kg Körpergewicht.
In einer Studie mit 60 verschiedenen Lebensmitteln, die kommerziell erhältlich sind, waren NP in allen Lebensmitteln in einer Konzentration von 0,1 bis 19,4 µg/kg zu finden. Aus diesen Daten ließ sich eine tägliche Aufnahme von 7,5 µg/Tag NP für einen Erwachsenen und durch Muttermilch bzw. Babynahrung von 0,2 bzw. 1,4 µg/Tag NP berechnen.[21]
Biologischer Abbau
Generell kann gesagt werden, dass das lineare Nonylphenol recht schnell abgebaut wird, während sich die verzweigten Verbindungen wesentlich persistenter verhalten. Neben vielen erfolglosen Experimenten gibt es aber auch einige Artikel, die über den Abbau von verzweigten (branched) Nonylphenolen im Boden und Wasser berichten.[22][23] Diese Experimente zeigen weiterhin, dass sich die Zusammensetzung des Nonylphenolgemisches durch den Abbau verändert. Zur Untersuchung wurden Nonylphenol-Isomere systematisch synthetisiert[24] und ihr mikrobiologischer Abbau untersucht.[25]
Bei den NPEO wird zunächst die Ethoxylatkette mehrmals um Einheiten von jeweils zwei Kohlenstoffatomen verkürzt, bis nur noch eine oder zwei Ethoxygruppen vorhanden sind. Je nach Milieu (aerob oder anaerob) können so auch die entsprechenden Carbonsäuren entstehen. Je kürzer die Ethoxylatkette wird, umso langlebiger und auch hormonell wirksamer werden die Substanzen. In verzweigten Nonylphenolen erreichen Nonylphenolethoxylate letztendlich ihr kaum mehr biologisch abbaubares Endprodukt, das zudem hormonell wirksamer ist als die Ursprungssubstanz oder Zwischenprodukte.
Analytik
In der Literatur werden verschiedene Techniken beschrieben um die einzelnen Isomere voneinander zu trennen. So finden nicht nur kapillar-gaschromatographische Techniken mit einer massenspektrometrischen Detektion (GC-MS) Anwendung[26][27] sondern auch zweidimensionale GCxGC-Messungen mit einer flugzeitmassenspektrometrischen Detektion (GCxGC-ToF-MS).[28][29] Weiterhin können die NPs auch mit Hochleistungsflüssigkeitschromatographie (HPLC) voneinander getrennt werden.[15] Trennungen von Nonylphenol-Enantiomeren können mit speziellen enantioselektiven Kapillarsäulen auf einem GC-FID-System durchgeführt werden.[16] Bereits in vielen umweltrelevanten Proben konnten Nonylphenole detektiert werden.[30] Wie zum Beispiel in Lebensmitteln[21][31][32], Trinkwasser[33] und Humanproben.[34][35] Für den Nachweis in Oberflächenwasser- oder Abwasserproben steht seit 2006 die ISO/EN/DIN 18857-2 zur Verfügung.[36]
Weblinks
- Markus Naaßner: Metabolismus und Verhalten definierter Nonylphenolisomere in Belebtschlamm (PDF; 809 kB), Dissertation, Aachen, 2004.
- Greenpeace: Nonylphenol – Hormongift in unseren Lebensmitteln (PDF; 110 kB, 4 Seiten, 09/2003).
- Greenpeace: Chemie außer Kontrolle – Hormongift in unseren Lebensmitteln (PDF; 35 kB, 4 Seiten).
- Greenpeace: Immer noch Nonylphenol in der Wäsche (PDF; 131 kB, 2 Seiten).
- Greenpeace: Bundesamt schützt Pestizidproduzenten (Memento vom 4. November 2013 im Webarchiv archive.today).
Einzelnachweise
- Richtlinie 2000/60/EG des Europäischen Parlaments und des Rates vom 23. Oktober 2000 zur Schaffung eines Ordnungsrahmens für Maßnahmen der Gemeinschaft im Bereich der Wasserpolitik, abgerufen am 7. November 2016
- European Chemicals Agency, Committee for Risk Assessment (RAC): Nonylphenol and nonylphenol ethoxylates. Technical report. 2. ECHA, 2014, abgerufen am 4. November 2016.
- Todd F. Wheeler, John R. Heim, Maria R. LaTorre, A. Blair Janes: Mass Spectral Characterization of p-Nonylphenol Isomers Using High-Resolution Capillary GC–MS. In: Journal of Chromatographic Science. Band 35, Nr. 1, 1. Januar 1997, S. 19–30, doi:10.1093/chromsci/35.1.19 (chromsci.oxfordjournals.org [abgerufen am 7. November 2016]).
- Bjoern Thiele, Volkmar Heinke, Einhard Kleist, Klaus Guenther: Contribution to the Structural Elucidation of 10 Isomers of Technical p-Nonylphenol. In: Environmental Science & Technology. Band 38, Nr. 12, 2004, S. 3405–3411, doi:10.1021/es040026g.
- Alexander S. Ruß, Ralph Vinken, Ingolf Schuphan, Burkhard Schmidt: Synthesis of branched para-nonylphenol isomers: Occurrence and quantification in two commercial mixtures. In: Chemosphere. Band 60, Nr. 11, 1. September 2005, S. 1624–1635, doi:10.1016/j.chemosphere.2005.02.046.
- Klaus Guenther, Einhard Kleist, Bjoern Thiele: Estrogen-active nonylphenols from an isomer-specific viewpoint: a systematic numbering system and future trends. In: Analytical and Bioanalytical Chemistry. Band 384, Nr. 2, 10. Dezember 2005, S. 542–546, doi:10.1007/s00216-005-0181-8.
- Eintrag zu Nonylphenol, Isomere in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. August 2017. (JavaScript erforderlich)
- Nonylphenol and nonylphenol ethoxylates, Tricresyl phosphates and Benzoic acid, Danish Environmental Protection Agency. (Nicht mehr online verfügbar.) In: www.statensnet.dk. Archiviert vom Original am 7. November 2016; abgerufen am 7. November 2016. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Richtlinie 2003/53/EG des europäischen Parlaments und des Rates vom 18. Juni 2003 zur 26. Änderung der Richtlinie 76/769/EWG des Rates über Beschränkungen des Inverkehrbringens und der Verwendung gewisser gefährlicher Stoffe und Zubereitungen (Nonylphenol, Nonylphenolethoxylat und Zement), abgerufen am 6. November 2016.
- Reinhard Wolff: Schmutzige Tücher. In: Die Tageszeitung. 13. September 2007, S. 8 (taz.de).
- P.-C. Lee, W. Lee: In vivo estrogenic action of nonylphenol in immature female rats. In: Bull Environ Contam Toxicol. Band 57, 1996, S. 341–348.
- J. Odum, P. A. Lefevre, S. Tittensor, D. Paton, E. J. Routledge, N. A. Beresford, J. P. Sumpter, J. Ashby: The rodent uterotrophic assay: critical protocol features, studies with nonyl phenols, and comparison with a yeast estrogenicity assay. In: Reg Toxicol Pharmacol. Band 25, 1997, S. 176–188.
- Thomas G. Preuss, Jacqueline Gehrhardt, Kristin Schirmer, Anja Coors, Mascha Rubach: Nonylphenol Isomers Differ in Estrogenic Activity. In: Environmental Science & Technology. Band 40, Nr. 16, 2006, S. 5147–5153, doi:10.1021/es060709r.
- Klaus Guenther, Volkmar Heinke, Bjoern Thiele, Einhard Kleist, Hartmut Prast: Endocrine Disrupting Nonylphenols Are Ubiquitous in Food. In: Environmental Science & Technology. Band 36, Nr. 8, 2002, S. 1676–1680, doi:10.1021/es010199v.
- Yun-Seok Kim, Takao Katase, Sayaka Sekine, Tadashi Inoue, Mitsuko Makino: Variation in estrogenic activity among fractions of a commercial nonylphenol by high performance liquid chromatography. In: Chemosphere. Band 54, Nr. 8, 1. Februar 2004, S. 1127–1134, doi:10.1016/j.chemosphere.2003.09.024.
- Ismail-Hakki Acir, Matthias Wüst, Klaus Guenther: Enantioselective separation of defined endocrine-disrupting nonylphenol isomers. In: Analytical and Bioanalytical Chemistry. Band 408, Nr. 20, 28. Mai 2016, S. 5601–5607, doi:10.1007/s00216-016-9661-2.
- Haifeng Zhang, Sebastian Zuehlke, Klaus Guenther, Michael Spiteller: Enantioselective separation and determination of single nonylphenol isomers. In: Chemosphere. Band 66, Nr. 4, 1. Januar 2007, S. 594–602, doi:10.1016/j.chemosphere.2006.08.012.
- Haifeng Zhang, Iris M. Oppel, Michael Spiteller, Klaus Guenther, Gabriele Boehmler: Enantiomers of a nonylphenol isomer: Absolute configurations and estrogenic potencies. In: Chirality. Band 21, Nr. 2, 1. Februar 2009, S. 271–275, doi:10.1002/chir.20556.
- Nonylphenol beeinflusst Kohäsion. In: Die Welt. 25. Oktober 2007, abgerufen am 6. November 2016.
- Mitteilung der University of Sydney: Aquariumversuch mit Nonylphenol. 26. Oktober 2007, abgerufen am 6. November 2016.
- K. Guenther, V. Heinke, B. Thiele, E. Kleist, H. Prast, T. Raecker: Endocrine disrupting nonylphenols are ubiquitous in food. In: Environ Sci Technol. Nr. 36, 2002, S. 1676–80.
- T. Tanghe, W. Dhooge, W. Verstraete: Isolation of a bacterial strain able to degrade branched nonylphenol. In: Appl. Environ. Microbiol. Band 65, Nr. 2, 1999, S. 746–751.
- Zhijiang Lu, Rubén Reif, Jay Gan: Isomer-specific biodegradation of nonylphenol in an activated sludge bioreactor and structure–biodegradability relationship. In: Water Research. Band 68, 1. Januar 2015, S. 282–290, doi:10.1016/j.watres.2014.09.050.
- Roswitha M. Boehme, Thomas Andries, Karl Heinz Dötz, Bjoern Thiele, Klaus Guenther: Synthesis of defined endocrine-disrupting nonylphenol isomers for biological and environmental studies. In: Chemosphere. Band 80, Nr. 7, 1. August 2010, S. 813–821, doi:10.1016/j.chemosphere.2010.03.064.
- Frédéric L. P. Gabriel, Edwin J. Routledge, Andy Heidlberger, Daniel Rentsch, Klaus Guenther, Walter Giger, John P. Sumpter, Hans-Peter E. Kohler: Isomer-specific degradation and endocrine disrupting activity of nonylphenols. In: Environ Sci Technol. Band 42, Nr. 17, 23. Juli 2008, S. 6399–6408, doi:10.1021/es800577a.
- W. Giger, E. Stephanou, C. Schaffner: Persistent organic chemicals in sewage effluents: I. Identifications of nonylphenols and nonylphenolethoxylates by glass capillary gas chromatography/mass spectrometry. In: Chemosphere. 10. Auflage. 1981, S. 1253–1263.
- T. F. Wheeler, J. R. Heim, M. R. LaTorre, A. B. Janes: Mass spectral characterization of p-nonylphenol isomers using high-resolution capillary GC–MS. In: J. Chromatogr. Sci. 35. Auflage. 1997, S. 19–30.
- M. Moeder, C. Martin, J. Harynuk, T. Górecki, R. Vinken: Identification of isomeric 4-nonylphenol structures by gas chromatography–tandem mass spectrometry combined with cluster analysis. In: Journal of Chromatography A. Band 1102, Nr. 1–2, 13. Januar 2006, S. 245–255, doi:10.1016/j.chroma.2005.10.031.
- Robert P. Eganhouse, James Pontolillo, Richard B. Gaines, Glenn S. Frysinger, Frédéric L. P. Gabriel: Isomer-Specific Determination of 4-Nonylphenols Using Comprehensive Two-Dimensional Gas Chromatography/Time-of-Flight Mass Spectrometry. In: Environmental Science & Technology. Band 43, Nr. 24, 15. Dezember 2009, S. 9306–9313, doi:10.1021/es902622r.
- B. Thiele, K. Guenther, M. J. Schwuger: Alkylphenol ethoxylates: trace analysis and environmental behaviour. In: Chem Rev. 97. Auflage. 1997, S. 3247–3272.
- Torsten Raecker, Bjoern Thiele, Roswitha M. Boehme, Klaus Guenther: Endocrine disrupting nonyl- and octylphenol in infant food in Germany: Considerable daily intake of nonylphenol for babies. In: Chemosphere. Band 82, Nr. 11, 1. März 2011, S. 1533–1540, doi:10.1016/j.chemosphere.2010.11.065.
- Nathan G. Dodder, Keith A. Maruya, P. Lee Ferguson, Richard Grace, Susan Klosterhaus: Occurrence of contaminants of emerging concern in mussels (Mytilus spp.) along the California coast and the influence of land use, storm water discharge, and treated wastewater effluent. In: Marine Pollution Bulletin (= U.S. Coastal Monitoring: NOAA’s Mussel Watch investigates Contaminants of Emerging Concern). Band 81, Nr. 2, 30. April 2014, S. 340–346, doi:10.1016/j.marpolbul.2013.06.041.
- Silvia Maggioni, Patrick Balaguer, Claudia Chiozzotto, Emilio Benfenati: Screening of endocrine-disrupting phenols, herbicides, steroid estrogens, and estrogenicity in drinking water from the waterworks of 35 Italian cities and from PET-bottled mineral water. In: Environmental Science and Pollution Research. Band 20, Nr. 3, 21. Juli 2012, S. 1649–1660, doi:10.1007/s11356-012-1075-x.
- Fulvio Ferrara, Nicoletta Ademollo, Maria Antonietta Orrù, Leopoldo Silvestroni, Enzo Funari: Alkylphenols in adipose tissues of Italian population. In: Chemosphere. Band 82, Nr. 7, 1. Februar 2011, S. 1044–1049, doi:10.1016/j.chemosphere.2010.10.064.
- Mo Chen, Zhanlan Fan, Fanrong Zhao, Fumei Gao, Di Mu: Occurrence and Maternal Transfer of Chlorinated Bisphenol A and Nonylphenol in Pregnant Women and Their Matching Embryos. In: Environmental Science & Technology. Band 50, Nr. 2, 2016, S. 970–977, doi:10.1021/acs.est.5b04130.
- DIN EN ISO 18857-2 Wasserbeschaffenheit - Bestimmung von ausgewählten Alkylphenolen - Teil 2: Gaschromatographisch-massenspektrometrische Bestimmung von Alkylphenolen, deren Ethoxylaten und Bisphenol A für nichtfiltrierte Proben unter Verwendung der Festphasenextraktion und Derivatisierung (ISO 18857-2:2009); Deutsche Fassung EN ISO 18857-2:2011. Abgerufen am 21. September 2020.