Lanthandiiodid
Lanthandiiodid ist eine anorganische chemische Verbindung des Lanthans aus der Gruppe der Iodide. Da sie dreiwertiges Lanthan und freie Elektronen enthält, kann sie auch als La3+[(I−)2e−] formuliert werden.[4]
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
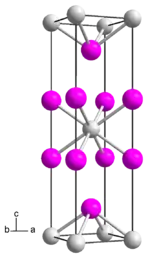 | |||||||
| _ La3+ _ I− | |||||||
| Allgemeines | |||||||
| Name | Lanthandiiodid | ||||||
| Verhältnisformel | LaI2 | ||||||
| Kurzbeschreibung |
blauschwarzer Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 392,71 g·mol−1 | ||||||
| Aggregatzustand |
fest[2] | ||||||
| Dichte |
5,46 g·cm−3[1] | ||||||
| Schmelzpunkt | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Gewinnung und Darstellung
Lanthandiiodid entsteht durch Reduktion von Lanthaniodid mit Lanthan im Vakuum bei 800 bis 900 °C.[2]
Auch die Darstellung durch Reaktion von Lanthan mit Quecksilber(II)-iodid ist möglich.[2]
Die Verbindung wurde 1961 durch John D. Corbett erstmals synthetisiert.[5]
Eigenschaften
Lanthandiiodid ist ein undurchsichtig dunkler, in kompakter Form stark glänzender Feststoff von metallähnlichem Aussehen und Charakter. Er ist äußerst hygroskopisch und kann nur unter sorgfältig getrocknetem Schutzgas oder im Hochvakuum aufbewahrt und gehandhabt werden. An Luft geht er unter Feuchtigkeitsaufnahme in Hydrate über, die aber instabil sind und sich mehr oder weniger rasch unter Wasserstoff-Entwicklung in Oxidiodide verwandeln. Mit Wasser spielen sich diese Vorgänge noch sehr viel schneller ab.[2] Er kristallisiert im MoSi2-Strukturtyp mit der Raumgruppe I4/mmm (Raumgruppen-Nr. 139) und enthält dreiwertiges Lanthan. Jedes La3+ ist in dieser Struktur von acht I− in einer etwas gestauchten würfelförmigen Formation umgeben.[6]
Einzelnachweise
- Smith L. Holt: Inorganic Syntheses. John Wiley & Sons, 2009, ISBN 0-470-13288-4, S. 36 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 1081.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 2. Band: Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049590-4, S. 1789 (Leseprobe: Teil C – Nebengruppenelemente. Google-Buchsuche).
- Angelika Jungmann, R. Claessen, R. Zimmermann, Ge Meng, P. Steiner, S. Hüfner, S. Tratzky, K. Stöwe, H. P. Beck: Photoemission of LaI2 and CeI2. In: Zeitschrift für Physik B Condensed Matter. 97, 1995, S. 25–34, doi:10.1007/BF01317584.
- Christoph Janiak, Hans-Jürgen Meyer, Dietrich Gudat, Ralf Alsfasser: Riedel Moderne Anorganische Chemie - Christoph Janiak, Hans-Jürgen Meyer, Dietrich Gudat, Ralf Alsfasser. Walter de Gruyter, 2012, ISBN 3-11-024901-4, S. 240 (eingeschränkte Vorschau in der Google-Buchsuche).