Lampenbürstenchromosom
Lampenbürstenchromosomen sind vorübergehende Gestalt- und Funktionsformen der Chromosomen, die durch Bildung zahlreicher Schlaufen (Schleifen) im Lichtmikroskop wie Rundbürsten aussehen. Auf Grund ihrer Größe werden sie manchmal als Riesenchromosomen bezeichnet. Dieser Ausdruck wird jedoch auch für die anders aufgebauten Polytänchromosomen verwendet.[1]
Zoologie
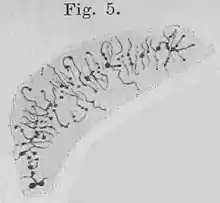
Besonders auffällig sind Lampenbürstenchromosomen in Zellkernen der Oozyten I bei Molchen und Salamandern, weil diese sehr große Genome besitzen. Die Schlaufen entstehen in den Eierstöcken dieser Amphibien während der Eibildung (Oogenese), und zwar im Diplotän (Teil der meiotischen Prophase I). Dabei geben sich die Lampenbürstenchromosomen als Bivalente zu erkennen, da jeweils zwei homologe Partner durch Chiasmata verbunden sind. Die Diplotän-Kerne besitzen einen DNA-Gehalt von 4 C. Lampenbürstenchromosomen beschrieb erstmals Walther Flemming im Oozytenkern des seinerzeit als Siredon pisciformis bezeichneten Axolotl. Den Namen vergab J. Rückert 1892. Lampenbürstenchromosomen wurden auch in den Oozyten von Vögeln, Reptilien, Haien und Knochenfischen, manchen Mollusken und einigen Insekten gefunden.[2]
Sonderfälle
Arten der Taufliege Drosophila entfalten Lampenbürsten, aber nur an den beiden Chromatiden des Y-Chromosoms in den Spermatozyten I, also in Männchen während der Spermien-Bildung (Spermatogenese).[3][4] Unter den Pflanzen ist lediglich bei der Meeresalge Acetabularia ein Lampenbürstenstadium bekannt, das in ihrem einzigen Zellkern vor der Gametenbildung auftritt.[5]
Funktion
Die Schlaufen entfalten sich diskontinuierlich aus den mit Proteinen besetzten DNA-Achsen der vier Chromatiden eines jeden Bivalents. Von der DNA der Schlaufen werden große Mengen RNA transkribiert, indem RNA-Polymerase-Moleküle von einem Startpunkt aus, dicht hintereinander, eine Schlaufe entlang lesen. Die wachsenden RNA-Moleküle werden mit Proteinen bepackt, bleiben selbstverständlich mit ihrer RNA-Polymerase und damit mit der Schlaufe verbunden. Vor allem im Elektronenmikroskop wird deutlich, dass Schlaufen aus einer oder auch aus mehreren Transkriptionseinheiten bestehen.[6] Die transkribierende Schlaufen-DNA macht allerdings nur um die 2 % der gesamten DNA des Zellkernes aus.[7] Die dennoch enorme RNA-Synthese in Oozyten liefert das Material, das nach der Befruchtung nötig ist, um einem Embryo schnelles Wachstum zu ermöglichen.
Jene Insekten, die keine Lampenbürsten zeigen, produzieren das nötige Material in großen Nährzellen, die die Oozyte umgeben. Und Säuger haben eine lange Schwangerschaft, die eine Vorversorgung der Oozyte erübrigt.[8]
Chromosomenstruktur
Die Lampenbürstenchromosomen lieferten fundamentale Einsicht in die Organisation der Chromosomen. Jede Chromatide enthält nur eine, und zwar eine durchgängige DNA-Doppelhelix. Den Nachweis erbrachte Verdauung mit DNase I, einem Enzym, das Einstrangbrüche verursacht.[9] Eine solche mit Proteinen besetzte DNA-Achse kann an verschiedenen Stellen dekondensieren und dabei vorübergehend transkribierende Schlaufen entfalten. Nach vollzogener Genaktivität werden die Schlaufen programmgemäß in die Achse zurückgezogen.[10] Ähnliche, zeitweilige Schlaufen bilden die Chromatiden in den (transkriptionsaktiven) Puffs polytäner Chromosomen; an großen Balbiani-Ringen ist das gut zu sehen.[11]
Messungen der Viskoelastizität von DNA-Lösungen bestätigten, dass eine Doppelhelix ein ganzes Chromosom durchläuft, ohne vom Zentromer unterbrochen zu werden. In dieser Hinsicht übereinstimmende Befunde ergaben Drosophila americana, D. hydei, D. melanogaster und D. virilis.[12][13]
Literatur
- Bernd Beek: Chromosomale Funktionsstrukturen. In: Gertrud Linnert (Hrsg.) Cytogenetisches Praktikum. Fischer, Stuttgart/ New York 1977, ISBN 3-437-20157-3, S. 170–185.
- Harold Garnet Callan: Lampbrush chromosomes. Springer, Berlin 1986, ISBN 3-540-16430-8.
- Hans Kleinig, Peter Sitte: Zellbiologie. 4. Auflage. Fischer, Stuttgart 1999, ISBN 3-437-26010-3.
- P. Quick, A. Hauck: Lampenbürstenchromosomen und ihre Präparation. In: Mikrokosmos. 72, Heft 2/1983, ISSN 0026-3680, S. 44–54.
Einzelnachweise
- Rüdiger Wehner, Walter Gehring, Alfred Kühn: Zoologie. 24. Auflage. Georg Thieme Verlag, Stuttgart 2007, ISBN 978-3-13-772724-8, S. 41 (online bei Google Books).
- Lampenbürstenchromosomen. In: Walther Traut: Chromosomen. Klassische und molekulare Cytogenetik. Springer, Berlin/ Heidelberg u. a. 1991, ISBN 3-540-53319-2, S. 242–251.
- Günther F. Meyer: Die Funktionsstrukturen des Y-Chromosoms in den Spermatocytenkernen von Drosophila hydei, D. neohydei, D. repleta und einigen anderen Drosophila-Arten. In: Chromosoma. 14/1963, S. 207–255.
- T. J. M. Hulsebos, Johannes H. P. Hackstein, Wolfgang Hennig: Lampbrush loop-specific proteins of Drosophila hydei. In: Proceedings of the National Academy of Sciences USA. 81/1984, S. 3404–3408.
- Herbert Spring, Ulrich Scheer, Werner W. Franke, Michael F. Trendelenburg: Lampbrush-type chromosomes in the primary nucleus of the green alga Acetabularia mediterranea. In: Chromosoma. 50/1975, S. 25–43.
- Ulrich Scheer, Werner W. Franke, Michael F. Trendelenburg, Herbert Spring: Classification of loops of lampbrush chromosomes according to the arrangement of transcriptional complexes. In: Journal of Cell Science. 22/1976, S. 503–519.
- Herbert C. Macgregor: Recent developments in the study of lampbrush chromosomes. In: Heredity. 41/1980, S. 3–35.
- Lampbrush chromosomes. In: Adrian T. Sumner: Chromosomes. Organization and function. Blackwell, Oxford 2003, ISBN 0-632-05407-7, S. 171–181.
- Walther Traut: Chromosomen. Klassische und molekulare Cytogenetik. 1991, S. 245.
- Adrian T. Sumner: Chromosomes. Organization and function. 2003, S. 178.
- Heinz Sass: RNA polymerase B in polytene chromosomes. Immunofluorescent and autoradiographic analysis during stimulated and repressed RNA synthesis. In: Cell. 28/1982, S. 269–278.
- Ruth Kavenoff, Bruno H. Zimm: Chromosome-sized DNA molecules from Drosophila. In: Chromosoma. 41/1973, S. 1–27.
- Lynn C. Klotz, Bruno H. Zimm: Retardation times of deoxyribonucleic acid solutions, II. Improvements in apparatus and theory. In: Macromolecules. 5/1972, S. 471–481.