Hantz-Reaktionen
Als Hantz-Reaktionen wird eine Klasse von Reaktions-Diffusionssystemen bezeichnet, bei denen Reaktionen zwischen zwei Elektrolyten in einem Gel ein räumliches Niederschlagmuster mit einer speziellen Oberfläche ergeben. Die Niederschlagsoberfläche bildet eine Barriere für die weitere Diffusion der Elektrolyte, wodurch sich typische Muster von kolloidalen Präzipitatszonen ergeben.
| Dieser Artikel wurde auf der Qualitätssicherungsseite der Redaktion Chemie eingetragen. Dies geschieht, um die Qualität der Artikel aus dem Themengebiet Chemie formal und inhaltlich auf ein in der Wikipedia gewünschtes Niveau zu bringen. Wir sind dankbar für deine Mithilfe, bitte beteilige dich an der Diskussion (neuer Eintrag) oder überarbeite den Artikel entsprechend. |
In einigen Gelen (z. B. in einem Polyvinylalkohol-Gel) entstehen selbst innerhalb des Niederschlags periodisch organisierte mikroskopische Strukturen.
Das Experimentdesign ähnelt einem der Liesegangschen Ringe: Das Präzipitat kommt durch die Reaktion zwischen Elektrolyten in einem Hydrogel zustande, wobei ein "innerer" Elektrolyt im Gel selbst aufgelöst ist und der andere, "äußere" Elektrolyt aus einer hochkonzentrierten Lösung ins Gel diffundiert. Die Niederschlagszonen bilden sich hinter der Diffusionsfront des "äußeren" Elektrolyts und die Niederschläge werden durch das Gel am Entstehungsort festgehalten[1].
Sie sind nach dem ungarischen Biophysiker Peter Hantz benannt.
Reaktionsvarianten und Arten von gebildeten Mustern
Der erste Vertreter dieser Reaktionsklasse war die Reaktion NaOH (äußerer Elektrolyt) + CuCl2 (innerer Elektrolyt).[2] Später hat es sich erwiesen, dass auch NaOH + AgNO3,[3] CuCl2 + K3[Fe(CN)6],[4] NaOH + AlCl3[5] und NH3 + AgNO3[6] in mehreren Hydrogelen ein ähnliches Verhalten zeigten. Die erscheinenden Muster hängen auch von der Art des Hydrogels ab, welches den inneren Elektrolyt enthält.
Niederschlagsmuster, die sich bei diesen Reaktionen bilden, sind außerordentlich reich. Neben den Formen wie dreieckige Mustern, Helices und Kardioiden (Primäre Muster) können auch regelmäßige kolloidale Niederschlagsschichten mit einer Periodizität von weniger als 20 Mikrometern (mikroskopische, Sekundäre Muster) auftreten.
Primäre Muster
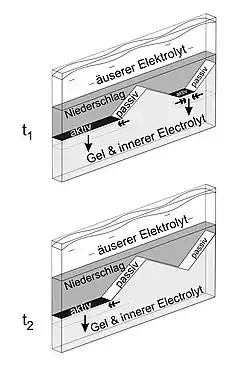

Die Anordnung, die am besten die Abfolge der Ereignisse, die zur Bildung primärer Muster führen, zeigt, ist diejenige, bei der der äußere Elektrolyt in eine dünne Gelschicht zwischen zwei Glasplatten eindringt. In diesem Fall haben sowohl die Diffusionsfront als auch die „aktive“" (vorrückende) Niederschlagsfront eine eindimensionale Form.[3][7] Wenn sich im Gel Verunreinigungen oder Hindernisse befinden, kann die Präzipitation an diesen Punkten aufhören, und die vorrückende Niederschlagsfront, die der Diffusionsfront folgt, wird sich aufteilen.
Wenn die Segmente der gebrochenen Niederschlagsfront (die aktiven Segmente) vorrücken, werden sie kürzer, was zu dreieckigen Regionen führt, die mit Niederschlag gefüllt sind. Gleichzeitig entstehen auch komplementäre, dreieckige Bereiche, die frei von Niederschlag sind (siehe Abbildung). Die Präzipitation hört in diesen leeren Bereichen vorübergehend oder dauerhaft auf, weil die schrägen, passiven Kanten des vorher gebildeten Niederschlagsoberfläche als Membrane wirken und die Diffusion des äußeren Elektrolyten (eine der Reagenzien) blockieren.[8]
Der Mechanismus hinter der Regression der aktiven Niederschlagfrontsegmente ist nicht vollständig geklärt. Es wird vermutet, dass sich an den aktiven Segmenten ein Zwischenprodukt bildet. Die Konzentration des Zwischenprodukts wird an den Rändern der aktiven Segmente (wo die aktiven Segmente und die passiven Kanten sich berühren) verringert, während eine kritische Konzentration erforderlich ist, damit die Präzipitation stattfindet. Diese kritische Konzentration wird an den Rändern der aktiven Segmente nicht erreicht; daher werden die nächsten Niederschlagsebenen kürzer sein.
Wenn der äußere Elektrolyt in einem Glasröhrchen auf die Oberseite einer Gelsäule gegossen wird, hat die Diffusionsfront ungefähr die Form einer (zweidimensionalen) Scheibe. In diesem Fall können die an der Musterbildung beteiligten aktiven Präzipitationsfronten kompliziertere Bewegungen ausführen, was zu komplexeren Niederschlagmustern führt, die von der äußeren und inneren Elektrolytkonzentration abhängen. Dazu gehören die Bildung von mehrarmigen Helices, ineinander gebetteten Kardioiden, Voronoi-Tessellationen[9] (z. B. für Reaktions-Diffusions-Computer),[10] sogenannten Zielmustern und anderen, noch komplexeren Formen.
Sekundäre, mikroskopische Muster

Unter bestimmten Bedingungen, beispielsweise wenn das Kation des Innenelektrolyten Cu2+ oder Ag2+ ist, werden regelmäßige mikroskopische Schichten aus kolloidalen Körnern gebildet.[11][6] Dieses Phänomen ist besonders auffällig, wenn die Reaktionen in Poly(vinyl)alkohol-Gel (PVA-Gel) ablaufen und die Geschwindigkeit der Niederschlagsfront unter etwa 0,3 μm/s fällt. Die feinsten sekundären, mikroskopischen Muster wurden bei den NaOH + AgNO3 -Reaktionen beobachtet, bei denen die Periodizität unter 10 μm abfiel. Der chemische Mechanismus dieser Musterbildung ist nicht vollständig geklärt; aber Computersimulationen auf der Grundlage der Phasentrennung, die durch die Cahn-Hilliard-Gleichung mit einer sich bewegenden Quellenfront beschrieben werden, zeigen die wichtigsten Eigenschaften des Aufbaus der mikroskopischen Muster.[12] Bei diesem Modell hinterlässt die sich bewegende Quellenfront eine gelöste Substanz (eine instabile Phase), die sich anschließend in leere beziehungsweise niederschlagsreiche Schichten (stabile Phasen) trennt.
Es können auch Defekte in den regulären Mikroschichten vorhanden sein, die sogar während der vorderen Ausbreitung interagieren können. Diese mikroskopischen Muster haben auch auf verschiedenen Gebieten der Mikro- und Nanotechnologie Interesse geweckt.[13]
Weblinks
Einzelnachweise
- Laura M. Barge, Noreen L. Thomas et al.: From Chemical Gardens to Chemobrionics. In: Chemical Reviews. Band 115, Nr. 16, 2015, S. 8652–8703, doi:10.1021/acs.chemrev.5b00014.
- Péter Hantz: Pattern Formation in the NaOH + CuCl2 Reaction. In: The Journal of Physical Chemistry B. Band 104, Nr. 17, 2000, ISSN 1520-6106, S. 4266–4272, doi:10.1021/jp992456c.
- P. Hantz: Pattern Formation in a New Class of Precipitation reactions (PDF), Thesis. Université de Genève, 2006.
- Benjamin P. J. de Lacy Costello, Péter Hantz, Norman M. Ratcliffe: Voronoi diagrams generated by regressing edges of precipitation fronts. In: The Journal of Chemical Physics. Band 120, Nr. 5, 2004, ISSN 0021-9606, S. 2413–2416, doi:10.1063/1.1635358.
- András Volford, Ferenc Izsák, Mátyás Ripszám, István Lagzi: Pattern Formation and Self-Organization in a Simple Precipitation System. In: Langmuir. Band 23, Nr. 3, 2007, ISSN 0743-7463, S. 961–964, doi:10.1021/la0623432.
- Edwin C. Constable, Catherine E. Housecroft, Artur Braun, Laurent Marot, Daniel Mathys, István Lagzi, Rita Tóth, Roché M. Walliser: Understanding the formation of aligned, linear arrays of Ag nanoparticles. In: RSC Advances. Band 6, Nr. 34, 2016, ISSN 2046-2069, S. 28388–28392, doi:10.1039/C6RA04194A.
- Stefan C. Müller, John Ross: Spatial Structure Formation in Precipitation Reactions. In: The Journal of Physical Chemistry A. Band 107, Nr. 39, 2003, ISSN 1089-5639, S. 7997–8008, doi:10.1021/jp030364o.
- Péter Hantz, Julian Partridge, Győző Láng, Szabolcs Horvát, Mária Ujvári: Ion-Selective Membranes Involved in Pattern-Forming Processes. In: The Journal of Physical Chemistry B. Band 108, Nr. 47, 2004, ISSN 1520-6106, S. 18135–18139, doi:10.1021/jp047081w.
- A. Adamatzky: Advances in Unconventional Computing 2016.
- Andy Adamatzki, Ben De Lacy Costello, Tetsuya Asai, Reaction-Diffusion Computers, Elsevier 2005, S. 42.
- Péter Hantz: Regular microscopic patterns produced by simple reaction–diffusion systems. In: Physical Chemistry Chemical Physics. Band 4, Nr. 8, 2002, ISSN 1463-9084, S. 1262–1267, doi:10.1039/B107742B.
- Péter Hantz, István Biró: Phase Separation in the Wake of Moving Fronts. In: Physical Review Letters. Band 96, Nr. 8, 2006, S. 088305, doi:10.1103/PhysRevLett.96.088305.
- B. A. Grzybowski: Chemistry in Motion: Reaction-Diffusion Systems for Micro- and Nanotechnology 2009.