Gribble-Aminierung
Die Gribble-Aminierung ist eine Namensreaktion der organischen Chemie, welche von Gordon W. Gribble 1974 veröffentlicht wurde. Bei der Aminierung handelt es sich um die Synthese von Indolinen oder N-alkylierten Indolinen.[1][2] Im Gegensatz zu anderen Verfahren können bei dieser Aminierung Indoline ohne Polymerisation hergestellt werden.[3]
Übersichtsreaktion
Die Synthese von Indolinen oder N-alkylierten Indolinen geschieht direkt über eine saure Reduktion von Indolen mit Natriumborhydrid in Essigsäure (H3C-COOH).[1][2]
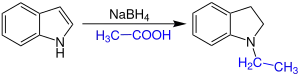
Alternativ kann auch Natriumcyanoborhydrid und Trifluoressigsäure verwendet werden. Bei der Reaktion mit Trifluoressigsäure entsteht nur das Indolin ohne N-Alkylierung.[1]
Reaktionsmechanismus
Als wahrscheinliches Reduktionsmittel agiert Natriumtriacetoxyborhydrid, welches sich unter Freisetzung von Wasserstoff aus Natriumborhydrid und Essigsäure bildet:[4]
Die Aminierung zur Synthese von einem N-alkylierten Indolin kann in drei Teilen beschrieben werden.

- Im ersten Teil wird das unalkylierte Indolin gebildet. Dabei wird Indol (1) zu Indolin (2) reduziert.
3.svg.png.webp)
- Im zweiten Teil bildet sich Acetaldehyd (4) entweder durch intramolekularen Hydrid-Transfer aus NaBH(OAc)3, oder durch intermolekulare Reduktion von Essigsäure (3). N-Acetylindolin, welches sich durch Kondensation von Indolin und Essigsäure bilden könnte, ist nachgewiesenerweise kein Intermediat der Reaktion.[5]
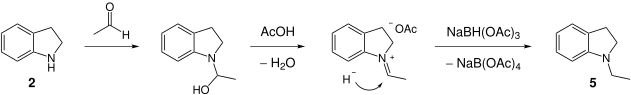
- Im dritten Teil reagiert Indolin (2) mit Acetaldehyd (4). Dabei greift das freie Elektronenpaar des Stickstoffs die Carbonylgruppe von 4 an. Nach Wasserabspaltung entsteht intermediär ein Iminiumion, welches durch Angriff eines Hydrids zum N-alkylierten Indolin 5 umgesetzt wird.
Modifikation
Mithilfe der Gribble-Aminierung können auch andere Heterocyclen reduziert werden.[1]
Anwendung
Im Allgemeinen wird diese Reaktion zur Reduktion von Indolen eingesetzt. Sie kann aber auch für die selektive Herstellung von unsymmetrischen tertiären Aminen verwendet werden.[1]
Einzelnachweise
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. Band 1. John Wiley & Sons, Inc., Hoboken, NJ, USA 2010, ISBN 978-0-471-70450-8, S. 1264–1266, doi:10.1002/9780470638859.
- Gordon W. Gribble, Pierre D. Lord, Jerauld Skotnicki, Stephen E. Dietz, Jefferson T. Eaton: Reactions of sodium borohydride in acidic media. I. Reduction of indoles and alkylation of aromatic amines with carboxylic acids. In: Journal of the American Chemical Society. Band 96, Nr. 25, Dezember 1974, S. 7812–7814, doi:10.1021/ja00832a035.
- Brian Robinson: Reduction of indoles and related compounds. In: Chemical Reviews. Band 69, Nr. 6, Dezember 1969, S. 785–797, doi:10.1021/cr60262a003.
- Gordon W. Gribble, Ahmed F. Abdel‐Magid: Sodium Triacetoxyborohydride. In: Encyclopedia of Reagents for Organic Synthesis. American Cancer Society, 2007, ISBN 978-0-470-84289-8, doi:10.1002/9780470842898.rs112.pub2 (wiley.com [abgerufen am 17. Dezember 2020]).
- Gordon W. Gribble, Pierre D. Lord, Jerauld Skotnicki, Stephen E. Dietz, Jefferson T. Eaton: Reactions of sodium borohydride in acidic media. I. Reduction of indoles and alkylation of aromatic amines with carboxylic acids. In: Journal of the American Chemical Society. Band 96, Nr. 25, Dezember 1974, ISSN 0002-7863, S. 7812–7814, doi:10.1021/ja00832a035 (acs.org [abgerufen am 17. Dezember 2020]).