Flüssigmetallbatterie
Eine Flüssigmetallbatterie ist ein elektrochemischer Energiespeicher, deren Anode, Kathode und Elektrolyt sich während des Betriebs im flüssigen Aggregatzustand befindet.[1][2][3] Für den Betrieb sind vergleichsweise hohe Temperaturen nötig, damit die einzelnen Materialien in flüssiger Form vorliegen, was eine entsprechende thermische Isolierung gegenüber der Umgebung erfordert. Diese Batterien zählen zu den Thermalbatterien. Flüssigmetallbatterien werden als stationärer Elektro-Energiespeicher für stark fluktuierende erneuerbare Energien diskutiert.[4][3][5][6]
Aufbau und Funktionsweise
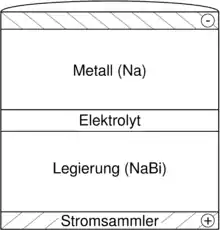
Flüssigmetallbatterien sind durch ein komplett flüssiges Inventar gekennzeichnet. Ein schweres Metall fungiert als Kathode, ein leichtes als Anode. Beide Metalle sind durch eine dünne Salzschmelze, dem Elektrolyt, voneinander getrennt. Werden die aktiven Materialien entsprechend ihrer Dichte passend gewählt, so „schwimmen“ die drei Phasen übereinander. Eine der bekanntesten Zellen ist die Na|NaCl-NaF-NaI|Bi-Zelle. Sie verwendet Natrium als Anode, Bismut als Kathode und eine Mischung mehrerer Natriumsalze als Elektrolyt.[1][2][7]
Während des Entladens gibt das Natrium ein Elektron ab
und diffundiert als Ion durch die Elektrolytschicht, wo es mit Bismut legiert:
- .
Natrium liegt in der Anode wie auch in der Kathode in der gleichen Oxidationsstufe vor. Daher handelt es sich um keine Bauform wie die historischen Daniell-Elemente bzw. die ebenfalls mit Dichteunterschieden arbeitenden Gravity-Daniell-Elemente, sondern um eine Konzentrations-Zelle. Die theoretische Zellspannung kann mit der Nernst-Gleichung zu
bestimmt werden.
Vor- und Nachteile
Die wichtigsten Vorteile der Flüssigmetallbatterie sind[4][3]:
- geringer Preis und hohe, einfache Verfügbarkeit der aktiven Materialien
- einfacher Aufbau
- extrem hohe Stromdichte (bis 130 kA/m²)
- hohe theoretische Lebensdauer (keine Elektrodendegradation)
- einfache Skalierbarkeit
Die bedeutendsten Nachteile sind:
- Lageabhängigkeit und damit keine oder stark eingeschränkte Anwendbarkeit in mobilen Anwendungen (was jedoch für den geplanten Einsatz als Speicher in Stromnetzen irrelevant ist)
- geringe Zellspannung (kleiner 1 V)
- hohe Arbeitstemperatur und die damit verbundenen Limitierungen
- unbekanntes Strömungsverhalten in komplett flüssigen Batterien
Nachweise
- C. Crouthamel, H. Recht (Hrsg.): Regenerative EMF Cells. Bd. 64. American Chemical Society, 1967.
- E. J. Cairns, C. E. Crouthamel, A. K. Fischer, M. S. Foster, J. C. Hesson, C. E. Johnson, H. Shimotake, A. D. Tevebaugh: Galvanic Cells with Fused-Salt Electrolytes. Argonne National Laboratory, 1967 (ANL-7316).
- Hojong Kim u. a.: Liquid Metal Batteries: Past, Present, and Future. In: Chemical Reviews. Band 113, Nr. 3, 13. März 2013, S. 2075–2099, doi:10.1021/cr300205k.
- D. J. Bradwell: Liquid Metal Batteries: Ambipolar Electrolysis and Alkaline Earth Electroalloying Cells. Massachusetts Institute of Technology, Dissertation, 2011.
- Norbert Weber, Vladimir Galindo, Frank Stefani, Tom Weier: Current-driven flow instabilities in large-scale liquid metal batteries, and how to tame them. In: Journal of Power Sources. Band 265, 1. November 2014, S. 166–173, doi:10.1016/j.jpowsour.2014.03.055.
- Kangli Wang u. a.: Lithium-antimony-lead liquid metal battery for grid-level energy storage. In: Nature. Band 514, Nr. 7522, 16. Oktober 2014, S. 348–350, doi:10.1038/nature13700.
- D. A. J. Swinkels: Molten Salt Batteries and Fuel Cells. In: J. Braunstein, G. Mamantov, G. P. Smith (Hrsg.): Advances in Molten Salt Chemistry Bd. 1, Plenum Press, New York 1971, Kap. 4, S. 165–223.