Felkin-Anh-Regel
Die Felkin-Anh-Regel ist eine Regel für die selektive Addition an Aldehyde und Ketone mit einem Stereozentrum in α-Position zur Carbonylgruppe. Sie wurde benannt nach Hugh Felkin und Nguyen T. Anh.
Cram-Regel
Donald J. Cram entwickelte 1952 die Theorie (Cramsche Regel), dass bei einer Addition an ein Aldehyd oder Keton mit Stereozentrum in α-Position ein bestimmter Übergangszustand für das entstehende Produkt verantwortlich sei. Der größte Rest steht dabei antiperiplanar zum Carbonylsauerstoff und das Nukleophil greift im Bürgi-Dunitz-Winkel, welcher nahe an 107° liegt, auf der Seite mit dem kleinsten Rest an.[1]
Weiterentwicklung durch Felkin und Anh
Da Crams Regel nicht immer das bevorzugte Produkt richtig vorhersagte, wurde sie von Felkin und später von Anh weiterentwickelt.
Ihrer Meinung nach richtet sich der Rest mit dem tiefstliegenden σ*C-R im rechten Winkel zur Doppelbindung aus. So überlappt das Orbital mit dem π*CO und bildet ein neues LUMO. Jener Rest ist entweder der sterisch anspruchsvollste Rest oder eine elektronenziehende Gruppe (z. B. Cl, Methoxygruppe). Das Nukleophil greift im Bürgi-Dunitz-Winkel auf der Seite mit dem geringeren sterischen Anspruch an.[2]
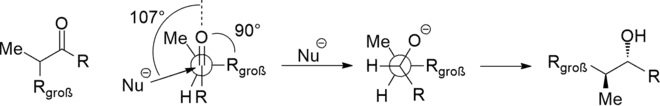
Konkurrenz durch das Cram-Chelat
In Konkurrenz zum Felkin-Anh-Übergangszustand steht der Cram-Chelat-Übergangszustand. In diesem werden der Carbonylsauerstoff und die elektronenziehende Gruppe (OR, NR2) von einem Metallion koordiniert. Da das Nukleophil wieder im Bürgi-Dunitz-Winkel auf der Seite mit dem geringeren sterischen Anspruch angreift, ergibt sich genau das anti-Felkin-Anh-Produkt.
Welches der beiden Produkte entsteht, hängt davon ab, welcher Rest an der elektronenziehenden Gruppe hängt und welches Metallion koordinieren soll.[3]
- Mit harten, stark koordinierenden Metallionen (z. B. Mg2+, Zn2+) wird eher das Cram-Chelat-Produkt gebildet, mit weicheren, weniger stark koordinierenden Metallionen (z. B. K+) eher das Felkin-Anh-Produkt.
- Mit einem sterisch weniger anspruchsvollen Rest (z. B. einem Benzylrest) entsteht das Cram-Chelat-Produkt, mit einem sterisch anspruchsvollen Rest (z. B. TBDMS) kann kein Chelatring gebildet werden und es entsteht das Felkin-Anh-Produkt.
Weitere Literatur
- P. Wyatt, S. Warren: Organic Synthesis (Strategy and Control). Wiley, Wiltshire u. a. 2007, ISBN 978-0-471-92963-5, S. 429–431.
- J. Clayden, N. Greeves, S. Warren, P. Wothers: Organic Chemistry. Oxford University Press, Oxford 2009, ISBN 978-0-19-850346-0.
- S. Guillarme, K. Plé, A. Banchet, A. Liard, A. Haudrechy: Alkynylation of Chiral Aldehydes: Alkoxy-, Amino- and Thioaldehydes. In: Chem. Reviews. 2006, 106, S. 2355–2403.
Einzelnachweise
- Reinhard Brückner: Reaktionsmechanismen: Organische Reaktionen, Stereochemie, Moderne Synthesemethoden. Spektrum Akademischer Verlag;, 2007, ISBN 3-8274-1579-9.
- Reinhard Brückner: Reaktionsmechanismen. Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-1579-0, S. 412.
- Reinhard Brückner: Reaktionsmechanismen. Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-1579-0, S. 418 f.