Briggs-Rauscher-Reaktion
Die Briggs-Rauscher Reaktion (auch oszillierende Iod-Uhr) gehört zu der kleinen Zahl bekannter, in homogener Lösung oszillierender Reaktionen. Die Reaktion ist vor allem wegen der Farbänderungen geeignet, den Mechanismus oszillierender Reaktionen darzustellen. Die Farbänderungen verlaufen von farblos über gelblich zu tiefblau, das wieder zum farblosen Ausgangszustand zurückkehrt, um den Zyklus mehrfach zu durchlaufen.
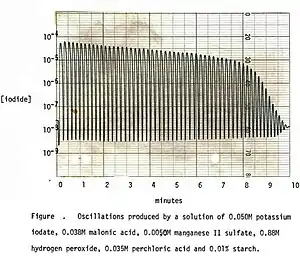
Geschichte
Die erste homogene oszillierende chemische Reaktion wurde von W. C. Bray im Jahr 1921 gefunden.[1] Es handelt sich um eine Reaktion von Wasserstoffperoxid (H2O2) und Iodat (IO3−) in saurer Lösung. Wegen der experimentellen Schwierigkeiten bekam die Reaktion nur wenig Beachtung und eignete sich nicht für die Demonstration des Effekts. 1958 entdeckte B. P. Belousov in der Sowjetunion die Belousov-Zhabotinsky-Reaktion,[2] die ebenfalls skeptisch aufgenommen wurde, da bis zu diesem Zeitpunkt oszillierende Reaktionen unbekannt waren. A. M. Zhabotinsky publizierte seine Forschungsergebnisse zu dieser Reaktion 1964[3] und im Mai 1972 im Journal of Chemical Education.[4][5] Durch diese Veröffentlichungen wurden zwei wissenschaftliche Mitarbeiter der Galileo High School in San Francisco auf die Reaktion aufmerksam. Sie entwickelten daraufhin die oszillierende Briggs-Rauscher-Reaktion,[6] indem sie das Bromat der Belousov-Zhabotinsky-Reaktion durch Iodat und Stärke als Indikator ersetzten. Die so genannte oszillierende Iod-Uhr zeigte die ablaufenden Reaktionen.
Mechanismus
Der detaillierte Reaktionsmechanismus ist komplex.[7][8] Als wichtige Schritte können zwei Schlüsselprozesse beschrieben werden:
- ein nicht-radikalischer Prozess A: die langsame Reaktion von freiem Iod und Malonsäure in der Gegenwart von Iodat unter Produktion eines intermediären Iodid-Ions.
- ein radikalischer Prozess B: ein schneller autokatalytischer Prozess des Manganats und freien Radikalen, die das Wasser und das Iodat in freies Iod und Sauerstoff überführen. Dieser Prozess verbraucht Iod bis zum geschwindigkeitsbestimmenden Schritt. Prozess B kann nur bei geringen Konzentrationen von Iodid auftreten, das ansonsten einen Rückkopplungsprozess auslöst.
Anfangs ist die Iodid-Konzentration gering und der Prozess B generiert freies Iod, das langsam akkumuliert. Währenddessen generiert der Prozess A langsam das intermediäre Iodid-Ion mit steigender Rate aus dem freien Iod. An einem bestimmten Punkt unterdrückt die Reaktion den Prozess B und stoppt somit die Produktion von freiem Iod (und damit Iodid), bis die Konzentration soweit abgenommen hat, dass Prozess B wieder abläuft. Der Prozess läuft solange ab, bis alle Reaktanten verbraucht sind.
Die Reaktion lässt sich annähernd durch die folgende Gleichung beschreiben:[8]
Die Farbänderung des Prozesses korrespondiert mit der Kinetik der beiden Prozesse. Die langsam ansteigende gelbliche Farbe ist auf die Produktion von freiem Iod durch Prozess B zurückzuführen. Wenn der Prozess B stoppt, führt die steigende Konzentration von Iodid-Ionen zum Farbumschlag nach blau, da sowohl Iod als auch Iodid-Ionen für die Bildung des Stärke-Komplexes notwendig sind. Weil immer noch Prozess A abläuft, geht der Farbumschlag wieder zurück zur farblosen Lösung. Die schließliche Wiederaufnahme des Prozesses B ist nicht sichtbar, kann aber elektrochemisch nachgewiesen werden.[6]
Eine negative Rückkopplung mit einer Verzögerung, die durch Prozess A vermittelt wird, ist der generelle Mechanismus, um oszillierende Reaktionen in physikalischen Systemen zu generieren, wird aber in nicht-biologischen homogenen chemischen Reaktionen nur selten beobachtet.
Weblinks
- Eine detaillierte Geschichte oszillierender Reaktionen (Memento vom 16. September 2008 im Internet Archive) (PDF; 177 kB).
Videos
Temperatureffekte
Einzelnachweise
- W. C. Bray: A Periodic Reaction in Homogeneous Solution and Its Relation to Catalysis. In: J. Am. Chem. Soc.. 43, Nr. 6, 1921, S. 1262–1267. doi:10.1021/ja01439a007.
- B. P. Belousov: Sbornik Referatov po Radiatsionni Meditsine In: Medgiz. Moscow 1958, S. 145. (übersetzt ins Englische: A Periodic Reaction and Its Mechanism In: R. J. Field, M. Burger (Hrsg.): Oscillations and Traveling Waves in Chemical Systems. J. Wiley & Sons, New York 1985).
- A. M. Zhabotinskii: Периодические окислительные реакции в жидкой фазе (Periodic oxidation reactions in liquid phase). In: Doklady Akademii Nauk SSSR. 157, Nr. 2, 1964, S. 392–393.
- R. J. Field: A reaction periodic in time and space. A lecture demonstration. In: Journal of Chemical Education. 49, 1972, S. 308, doi:10.1021/ed049p308.
- Hans Degn: Oscillating chemical reactions in homogeneous phase. In: Journal of Chemical Education. 49, 1972, S. 302, doi:10.1021/ed049p302.
- Thomas S. Briggs, Warren C. Rauscher: An oscillating iodine clock. In: Journal of Chemical Education. 50, 1973, S. 496, doi:10.1021/ed050p496.
- R. M. Noyes, S. D. Furrow: The oscillatory Briggs–Rauscher reaction. 3. A skeleton mechanism for oscillations. In: J. Am. Chem. Soc.. 104, Nr. 1, 1982, S. 45–48. doi:10.1021/ja00365a011.
- S. D. Furrow: Chemical Oscillators Based on Iodate Ion and Hydrogen Peroxide. In: R. J. Field, M. Burger (Hrsg.): Oscillations and Traveling Waves in Chemical Systems. J. Wiley & Sons, New York 1985.