Bombenkalorimeter
Ein Bombenkalorimeter (auch Berthelotsche Bombe, benannt nach Marcelin Berthelot, oder Kalorimetrische Bombe) dient zur Bestimmung des Brennwertes eines Stoffes unter einer Sauerstoffatmosphäre und hohem Druck.[1]

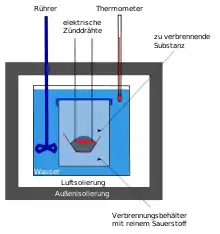
Aufbau und Funktionsweise
Bombenkalorimeter bestehen aus einem mit temperiertem Wasser (typischerweise 2.000 g) gefüllten Stahlcontainer, der als adiabat[2] angenommen werden kann und in dem sich neben der eigentlichen Bombe aus hochfestem Chromstahl ein Rührer und ein Thermometer befinden. In der Bombe, die typischerweise ein Innenvolumen von 340 cm3 aufweist, befindet sich eine Aufhängung für einen Tiegel, die Aufhängung dient gleichzeitig als elektrischer Leiter für den Zünddraht, der in der zu verbrennenden Substanz liegt. Gezündet wird anschließend entweder durch einen Lichtbogen oder durch die Hitze des stromdurchflossenen Zünddrahtes. Die Verbrennung findet bei einem Sauerstoffdruck von etwa 20–30 bar statt. Verbrannt wird üblicherweise ein Feststoff (0,5–1,5 g) in Form eines sogenannten Presslings. Der mechanische Zusammenhalt des Presslings in Pillenform bewirkt, dass das explosionsartig schnelle Verbrennen im Wesentlichen nur an der Oberfläche der Pille erfolgt. Das verhindert, dass unvollständig verbrannte Teile der Probe aus dem Tiegel weggeschleudert werden und an der kalten Wand der Bombe bis unter den Flammpunkt abgekühlt werden und daher nicht vollständig verbrennen.[3]
Während der Verbrennung erhöht sich die Temperatur in der Bombe, diese Wärme wird dann an das Wasser abgegeben und die Temperaturänderung im Wasser wird dann mit einem Thermometer genau gemessen. Durch die Messung der Erwärmung des Bombenkalorimeters kann auf den Brennwert geschlossen werden.[4][5]
Es gibt mehrere Messprinzipien. Die gängigsten sind das adiabatische und isoperibole Verfahren.[3]
Thermogramme
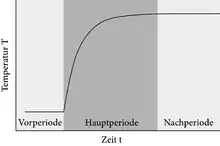
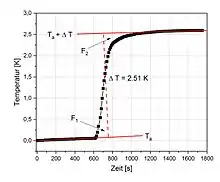
Ein Thermogramm zeigt das während der Reaktion aufgezeichnete Temperaturprofil T(t). Es wird in drei Abschnitte unterteilt: Die Vorperiode, die Hauptperiode (auch Sprunggebiet genannt) und die Nachperiode. In einem idealen adiabatischen Experiment zeigt das System in der Vorperiode eine konstante Temperatur, die sich nach dem Starten der Reaktion exponentiell an die neue Gleichgewichtstemperatur (Nachperiode) annähert, die anschließend ebenfalls konstant bleibt. Die Thermogramme nicht ideal adiabatischer Kalorimeter und isoperibolischer Kalorimeter können das ideale Temperaturprofil T(t) nur annähernd reproduzieren, da das System vor der Messung oft nicht vollständig equilibriert ist. Dies hat zur Folge, dass das Thermogramm während der Vor- und der Nachperiode noch eine leichte Temperaturdrift zeigt.[3]
Der Beispielgraph des Thermogramms eines nicht ideal adiabatischen Kalorimeters zeigt, dass die Reaktion am Ende der Vorperiode beim Zeitpunkt t = 600 s gestartet wurde. Die senkrecht auf der linearen Regression der Vor- und Hauptperiode liegende Gerade ergibt zwei gleich große Flächenstücke F1 und F2. Der Schnittpunkt der Senkrechten mit der Hauptperiode gibt die die mittlere Reaktionstemperatur bei 63 % des Temperatursprungs.
Berechnung thermodynamischer Größen
Für die Berechnung thermodynamischer Größen aus den gewonnenen Daten muss zunächst die Wärmekapazität (Kalorimeterkonstante) des Bombenkalorimeters bestimmt werden, dies erfolgt bei bekannter Substanz über die Innere Energie dieser Substanz, den Massenunterschied vor und nach der Verbrennung und den erzeugten Temperaturunterschied :[3]
Mit Hilfe der spezifischen Wärmekapazität des Wassers , der eingesetzten Wassermenge und dem -Wert ist es möglich, den Wasserwert des Kalorimeters zu bestimmen:
Sind thermodynamische Daten der Substanz nicht bekannt, so muss zunächst wie oben dargestellt die Wärmekapazität des Kalorimeters mit einer bekannten Substanz ermittelt werden. Daraus lässt sich dann die Innere Energie der unbekannten Substanz ermitteln, wenn die Molmasse bekannt ist:
Die Berechnung der Reaktionsenthalpie erfolgt anschließend über:
Unter der Annahme, dass die Gasphase als ideal angenommen werden kann, ist es möglich, die Gleichung umzuschreiben zu:
ist hier der Stoffmengenunterschied, der sich aus der Reaktionsgleichung ergibt. Kann die Gasphase nicht als ideal angenommen werden muss mit anderen Gleichungen gearbeitet werden, z. B. der Van-der-Waals-Gleichung.[6]
Siehe auch
Einzelnachweise
- spektrum.de: Bombenkalorimeter - Lexikon der Ernährung - Spektrum der Wissenschaft, abgerufen am 12. Februar 2017.
- TU München Messtechnik Bombenkalorimeter
- Erich Meister: Grundpraktikum Physikalische Chemie - Theorie und Experimente. 2. Auflage. vdf Hochschulverlag AG, Zürich 2012, ISBN 978-3-7281-3709-8, S. 179–186 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hochschule Aalen Bestimmung der Verbrennungsenergie mit dem Bombenkalorimeter (PDF). (Seite nicht mehr abrufbar)
- Universität Jena Molare Verbrennungs- und Bildungsenthalpie mit dem Bombenkalorimeter (PDF). (Seite nicht mehr abrufbar)
- Gabriele Cruciani: Kurzlehrbuch Physikalische Chemie. John Wiley & Sons, 2006, ISBN 3-527-31807-0, S. 134 (eingeschränkte Vorschau in der Google-Buchsuche).