Bergman-Cyclisierung
Die Bergman-Cyclisierung (fachsprachlich) bzw. Bergman-Zyklisierung ist eine Reaktion aus dem Bereich der organischen Chemie. Es handelt sich hierbei um eine thermische Umlagerung mit kurzlebigen radikalischen Zwischenprodukten. Benannt wurde sie nach ihrem Entdecker, dem US-amerikanischen Chemiker Robert George Bergman, der sie erstmals 1972 publizierte. Die Reaktion dient der Synthese von Benzolderivaten aus konjugierten Endiinen in Gegenwart von Wasserstoffdonoren.[1]
Die Bergman-Cyclisierung erklärt unter anderem den Wirkmechanismus von Endiin-Antibiotika. Dort insertiert das radikalische Intermediat in die DNA.
Mechanismus
Zunächst wird ein Endiin mit den Resten R1 bis R4 reversibel beim Erhitzen zu einem 1,4-Diyl umgesetzt. Dieses kann in Gegenwart eines Wasserstoffdonors [praktischerweise oft (wie im Beispiel) 1,4-Cyclohexadien ] zu einem mehrfach substituierten Aromaten mit den Resten R1 bis R4 und Benzol reagieren:[2]
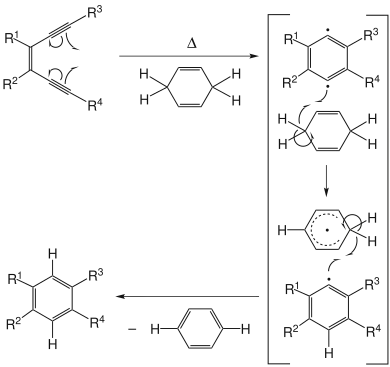 Mechanismus der Bergman-Cyclisierung.
Mechanismus der Bergman-Cyclisierung.
Je weiter die Dreifachbindungen im Dialkin räumlich voneinander entfernt sind, desto höher ist die nötige Temperatur; bei terminalen Alkinen kann die Temperatur über 200 °C liegen. Alkine, die schon eine cyclische Präorientierung besitzen, können meist bei wesentlich niedrigeren Temperaturen zur Reaktion gebracht werden.
Cyclisierung bei Körpertemperatur
Um Cyclisierung bei physiologischen Temperaturen zu erreichen, sollte die Endiin-Einheit Teil eines Zehnrings sein (n=1 im Beispiel unten).[3]
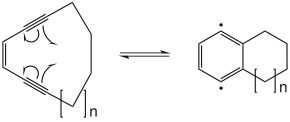 Beispiel für cyclische Präorientierung, Zehnring
Beispiel für cyclische Präorientierung, Zehnring
So beruht beispielsweise die biologische Aktivität der Calicheamicine auf der Spaltung der DNA. Wird das Molekül zum Reaktionsort transportiert, kommt es nach einer chemischen Reaktion zur Verringerung der Abstände zwischen den Dreifachbindungen, woraufhin eine Bergman-Cyclisierung zum benzoiden Diradikal erfolgt, welches in der Lage ist DNA zu spalten.[2]
Einzelnachweise
- Richard R. Jones, Robert G. Bergman: p-Benzyne. Generation as an intermediate in a thermal isomerization reaction and trapping evidence for the 1,4-benzenediyl structure. In: Journal of the American Chemical Society. Band 94, Nr. 2, 1972, S. 660–661.
- Thomas Laue, Andreas Plagens: Namen- und Schlagwortreaktionen der Organischen Chemie. Vieweg+Teubner, Wiesbaden 2009, ISBN 978-3-8351-0091-6.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Burlington/San Diego/London 2005, ISBN 0-12-369483-3.
Literatur
- Jie Jack Li: Name reactions: a collection of detailed reaction mechanisms. Springer, Berlin/Heidelberg/New York 2006, ISBN 978-3-540-30030-4, S. 49 (eingeschränkte Vorschau in der Google-Buchsuche).