Arens-van-Dorp-Reaktion
Die Arens-van-Dorp-Reaktion ist eine von den niederländischen Chemikern J. F. Arens und D. A. van Dorp entwickelte Namensreaktion der Organischen Chemie.[1][2][3] Sie beschreibt die Synthese von α,β-ungesättigten Aldehyden und stellte um 1947 einen ersten erfolgreichen Schritt zur Vitamin-A-Synthese dar.[2][3] Ebenfalls 1947 wurde von O. Isler eine Modifikation, die sogenannte Isler-Modifikation, entwickelt, die die industrielle Synthese von Vitamin A erleichtern sollte.[4]
Übersichtsreaktion
Die Arens-van-Dorp-Reaktion beschreibt die Reaktion von einer Carbonylverbindung und Ethoxyacetylen in Form einer Grignard-Verbindung zum α,β-ungesättigten Aldehyd.[2] In der Literatur werden im Wesentlichen Reaktionen zur Vitamin-A-Synthese angeführt, bei denen als Edukt ein Keton verwendet wird.[2][3][4] Ob beispielsweise auch Aldehyde als Edukte fungieren können, lässt sich der Literatur nicht eindeutig entnehmen. Eine vereinfachte Darstellung der Arens-van-Dorp-Reaktion sieht wie folgt aus (wobei R1 und R2 im Folgenden organische Reste sind):[2]
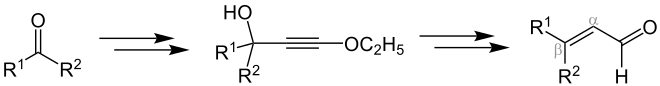
Im Detail betrachtet läuft die Arens-van-Dorp-Reaktion ausgehend von der Carbonylverbindung über eine Grignard-Reaktion zum Alkinderivat ab.[2] Die Herstellung der Grignard-Verbindung lässt sich dabei von den Arbeiten der Chemiker T. L. Jacobs, R. Cramer, T. Weiss und J. E. Hanson ableiten, in denen die Synthese von Phenoxyacetylenmagnesiumbromid und anderen Verbindungen ausgehend von Acetylenethern beschrieben wird.[5][6] Über die hier aufgeführte Synthese aus Ethoxyacetylen und Ethylmagnesiumbromid wird 1948 auch von den Chemikern M. N. Shchukina und I. A. Rubtsov berichtet.[7][8] Eine anschließende katalytische Hydrierung des Alkinderivats und die Umsetzung mit einer schwachen Säure führt zum α,β-ungesättigten Aldehyd:[2]
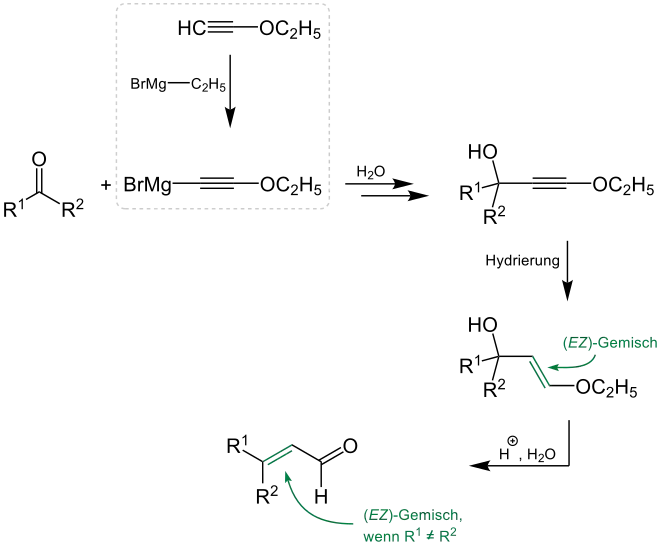
Die Isler-Modifikation verzichtet auf die Durchführung einer Grignard-Reaktion und verwendet stattdessen die Reaktion eines β-Chlorvinylethers mit Lithiumamid zur Herstellung von Lithiumethoxyacetylen, welches anschließend ebenfalls mit einem Keton versetzt wird.[1] Daraufhin lässt sich das entstandene Alkinderivat entsprechend der Arens-van-Dorp-Reaktion hydrieren und weiter umsetzen:[1]

Reaktionsmechanismus
Die Literatur gibt im Wesentlichen Aufschluss über den Reaktionsverlauf der Arens-van-Dorp-Reaktion, weniger über den Mechanismus.[2] Da der Reaktionsverlauf zur α,β-ungesättigten Carbonylverbindung oben dargestellt ist, wird im Folgenden nur auf den Mechanismus der Isler-Modifikation eingegangen.
Isler-Modifikation
Unter zweifacher Deprotonierung des β-Chlorvinylethers (1) durch das Lithiumamid erfolgt eine Abspaltung des Chlorids sowie die Ausbildung der Dreifachbindung. Von dem so entstandenen Lithiumethoxyacetylen (2) erfolgt ein nukleophiler Angriff auf das Carbonylkohlenstoffatom der Carbonylverbindung. Die Aufarbeitung des Alkinderivats wird in der Literatur nicht näher beschrieben. Eine Möglichkeit zur Aufarbeitung eines Lithiumalkoholats wäre die Umsetzung mit verdünnter Säure.[9] Das nach der Aufarbeitung vorliegende Alkinderivat (3) kann nun entsprechend der Arens-van-Dorp-Reaktion mittels katalytischer Hydrierung weiterverarbeitet werden.

Atomökonomie
Sowohl bei der Arens-van-Dorp-Reaktion, als auch bei der Ilser-Modifikation entstehen Nebenprodukte, so dass im Sinne atomökonomischer Betrachtungen nicht von effizienten Reaktionen gesprochen werden kann. Dies wird unter anderem durch auftretende Salzabfälle begründet. Zudem sollte die Entstehung von überwiegend organischen Abfällen im Rahmen der Grignard-Reaktion bedacht werden.
Ethoxyacetylen stellt als Ausgangsstoff zur Synthese der Grignard-Verbindung darüber hinaus ein schwer herzustellendes Edukt dar.[10] Das im Rahmen der Isler-Modifikation alternativ verwendete Lithiumethoxyacetylen lässt sich, laut Literatur, leichter herstellen.[10] Die Entstehung funktioniert ebenfalls in situ und die Reaktivität ist ähnlich wie bei der Grignard-Verbindung gegeben.[10] Die Empfindlichkeit der Grignard-Reaktion gegenüber Wasser räumt der Isler-Modifikation ebenfalls Vorteile in der industriellen Verarbeitung ein.
Wirtschaftliche Verwendung
Die vereinfachte Synthese im Sinne der Isler-Modifikation wurde im industriellen Bereich von dem Pharmaunternehmen Hoffmann-La Roche umgesetzt.[3] Ende des 20. Jahrhunderts geriet Hoffmann-La Roche, damals als weltweit führender Produzent von Vitamin A, im Rahmen der Untersuchungen der europäischen Kommission aufgrund von Preisabsprachen mit anderen führenden Unternehmen in die Kritik.[3] Zu dem Kartell gehörten ebenfalls die Unternehmen BASF und Rhône-Poulenc.[3] Im Jahr 2001 wurden Strafzahlungen von mehreren 100 Millionen Euro verhängt.[3] Vitamin A wird heutzutage hauptsächlich von DSM und BASF produziert.[3]
Einzelnachweise
- Daniel Zerong Wang: Comprehensive Organic Name Reactions and Reagents. Band 1. John Wiley & Sons, Inc., Hoboken New Jersey 2009, ISBN 978-0-471-70450-8, S. 100–102.
- J. F. Arens, D. A. van Dorp: A new method for the synthesis of α,β-unsaturated aldehydes. In: Recueil des travaux chimiques des Pays-Bas. Band 67, 1948, S. 973–976.
- Gemma L. Parker, Laura K. Smith, Ian R. Baxendale: Development of the industrial synthesis of vitamin A. In: Tetrahedron. Band 72, Nr. 13, 2016, S. 1645–1652, doi:10.1016/j.tet.2016.02.029.
- O. Isler, W. Huber, A. Ronco, M. Kofler: Synthese des Vitamin A. In: Helvetica Chimica Acta Band 30, Nr. 6, 1947, S. 1911–1927, doi:10.1002/hlca.19470300666.
- Thomas L. Jacobs, Richard Cramer, F. T. Weiss: Acetylenic Ethers. I. Phenoxyacetylenes. In: The Journal of the American Chemical Society. Band 62, Nr. 7, 1940, S. 1849–1854.
- Thomas L. Jacobs, Richard Cramer, John E. Hanson: Acetylenic Ethers. II. Ethoxy- and Butoxy-acetylene. In: The Journal of the American Chemical Society. Band 64, Nr. 1, 1942, S. 223–226.
- Jonathan Clayden, Nick Greeves, Stuart Warren, Peter Wothers: Organic Chemistry. Oxford University Press Inc., New York 2001, ISBN 0-19-850346-6, S. 213.
- M. N. Shchukina, I. A. Rubtsov: Syntheses through Ethoxyacetylenemagnesium Bromide. In: Zhurnal Obshchei Khimii. Band 18, 1948, S. 1645–1652.
- Sven Strunk, Manfred Schlosser: Wittig Rearrangement of Lithiated Allyl Aryl Ethers: A Mechanistic Study. In: European Journal of Organic Chemistry. Band 2006, Nr. 19, 2006, S. 4393–4397, doi:10.1002/ejoc.200600304.
- Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro Jr.: Name Reactions and Reagents in Organic Synthesis. Second Edition. John Wiley & Sons, Inc., Hoboken New Jersey 2005, ISBN 0-471-22854-0, S. 262.