σ-Bishomoaromatizität
σ-Bishomoaromatizität ist ein Extremfall der chemischen Bindung und der Aromatizität. Sie wurde erstmals im Rahmen der Pagodan-Route zur Synthese von Dodecahedran von Prinzbach et al. beschrieben.[1][2][3] Bei der σ-Bishomoaromatizität erfolgt cyclische Elektronendelokalisation innerhalb der durch die beteiligten Atome definierten Ebene (und nicht in einem zu dieser Ebene senkrecht ausgerichteten π-System, vgl. Benzol), wobei das den Perimeter definierende Bindungsgerüst zweifach unterbrochen ist. Die notwendige Konjugation findet an diesen beiden Stellen durch den Raum („through space“) statt.

Hintergrund I: „klassische“ und σ-Aromatizität
In der Organischen Chemie ist das Phänomen der Aromatizität[4] von grundlegender Bedeutung: am archetypischen Beispiel Benzol zeigt sich, dass die cyclische Konjugation von 4n+2 π-Elektronen (Hückel-Regel) zu einem deutlichen Stabilitätsgewinn und damit deutlich veränderter Reaktivität führt. Neben der erhöhten Stabilität ist die cyclische Delokalisation der Elektronen auch für einen diamagnetischen Ringstrom verantwortlich, der sich durch NMR-Messungen nachweisen lässt, sowie für eine Angleichung der Bindungslängen entlang des konjugierten Perimeters (vgl. die äquivalenten C-C-Bindungslängen in Benzol gegenüber der Alternanz von C-C-Einfach- und C=C-Doppelbindungslängen im hypothetischen Cyclohexatrien).
Erfolgt die cyclische Delokalisation nicht in einem π-System, sondern durch Wechselwirkung von σ-Bindungen in der Ebene, so spricht man von σ-Aromatizität. σ-Aromatizität ist an strenge geometrische Randbedingungen geknüpft und wird im Falle von Cyclopropan gefunden: seine magnetischen Eigenschaften weisen auf einen diamagnetischen Ringstrom hin, seine gegenüber Cyclobutan vergleichsweise geringe Spannungsenergie (120,17 vs. 111,79 kJ/mol) wird neben Stabilisierung durch intrinsisch stärkere CH-Bindungen (netto-Effekt 33,5 kJ/mol) auf eine aromatische Stabilisierung durch σ-Aromatizität von 47,3 kJ/mol zurückgeführt.[5] und Intrinsische Bindungsenergien.
Hintergrund II: Homoaromatizität
Im klassischen Fall wird Aromatizität durch cyclische Elektronendelokalisation in einem π-System erreicht, das durch einen kontinuierlichen, von σ-Bindungen definierten Perimeter definiert wird. Wird dieser σ-Perimeter an einer Stelle unterbrochen, kann die Wechselwirkung der betreffenden π-Orbitale an dieser Stelle bei günstigem Abstand und günstiger Orientierung immer noch stattfinden. In diesem Fall spricht man von Homokonjugation, die „durch den Raum“/„through space“ stattfindet und in geeigneten Systemen zu Homoaromatizität führt. Typische Beispiele finden sich im Homotropylium-Kation oder im Cycloheptatrien.[6]
Beispiele für σ-Bishomoaromatizität
Lässt man unter geeigneten Bedingungen (Erzwingen der notwendigen geometrischen Anordnung durch starre Käfigsysteme) zwei C-C-Doppelbindungen σ-artig überlappen, so bilden die π-Orbitale einen geschlossenen Perimeter in der σ-Ebene, der eine cyclische Elektronendelokalisation erlaubt. Die zugehörigen Orbitale sind im nebenstehenden Schema dargestellt, wobei die energetische Lage und Reihenfolge der b1- und b2-Orbitale vom Abstand der beiden Doppelbindungen abhängt.

Realisiert wird eine solche Anordnung zweier Doppelbindungen im bisseco-Dodecahedradien (vgl. Abbildung).[7]
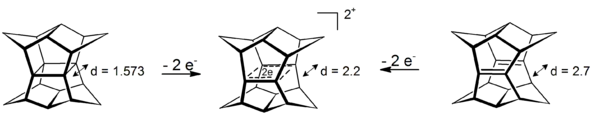
- Abb.:Oxidation von Pagodan und bisseco-Dodecahedradien zum sigma-bishomoaromatischen 4-Zentren-2-Elektronen-Dikation. Abstände in Angström (Röntgenstruktur für Pagodan, HF/3-21G-Rechnung für das Dien und das Dikation)
Wird das σ-bishomokonjugierte Orbitalsystem mit 2 Elektronen besetzt (Zugang durch Oxidation der neutralen Spezies, besetzt wird nur das energetisch niedrigste a1-Orbital), erhält man erstaunlich persistente 4-Zentren-2-Elektronen-Dikationen (4C/2e), deren hohe Persistenz u. a. auf σ-Bishomoaromatizität zurückgeführt wird. Anstatt der neutralen Vorstufen mit den σ-überlappenden C-C-Doppelbindungen kann auch Pagodan mit seinem zentralen Cyclobutanring eingesetzt werden. Die Reduktion entsprechender neutraler Spezies zum Dianion, einem 4-Zentren-6-Elektronen σ-Bishomoaromaten, ist wissenschaftlich hoch interessant (Hückel-Regel), gelang mit den Kohlenstoff-Verbindungen jedoch bisher nicht. Dies wurde erst erreicht, als die C-C-Doppelbindungen gegen N-N-Doppelbindungen ausgetauscht wurden (Bis-Diazene, vgl. Abbildung).[8][9][10]
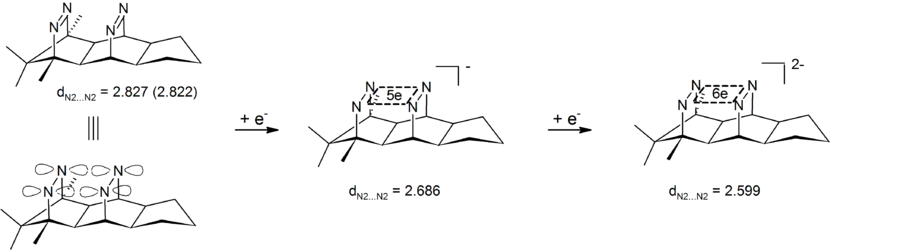
- Abb.: Zweistufige Reduktion eines Bisdiazens zum 4-Zentren-6-Elektronen-Dianion. Abstände in Angström (Röntgenstruktur für die Neutralverbindung, B3LYP/6-31G*-Rechnung für das Mono- und Dianion)
Mit geeigneten hochrigiden Substraten lassen sich dabei durch 2-Elektronenreduktion erstaunlich persistente Dianionen erzeugen, bei denen sechs Elektronen cyclisch in der Ebene delokalisiert sind (4-Zentren-6-Elektronen-Dianionen, 4N/6e). Oxidation der Bisdiazene zu den entsprechenden Bisdiazentetroxiden liefert schließlich Substrate, die sich überraschend leicht zu wiederum ungewöhnlich persistenten Dikationen oxidieren lassen. In diesem Falle ist noch zu klären, ob die Dikationen als weiterer Beleg für 2-Elektronen σ-Bishomoaromaten (4N/2e) oder als Beispiel für eine kubische Delokalisation in einem 4O4N/10e-System zu beschreiben sind.[11]
Einzelnachweise
- G. K. S. Prakash, V. V. Krishnamurthy, R. Herges, R. Bau, H. Yuan, G. A. Olah, W.-D. Fessner, H. Prinzbach J. Am. Chem. Soc. 1986, 108, 836.
- G. K. S. Prakash, V. V. Krishnamurthy, R. Herges, R. Bau, H. Yuan, G. A. Olah, W.-D. Fessner, H. Prinzbach J. Am. Chem. Soc. 1988, 110, 7764.
- R. Herges, P. v. R. Schleyer, M. Schindler, W.-D. Fessner J. Am. Chem. Soc. 1991, 113, 3649.
- P. v. R. Schleyer, H. Jiao: What is Aromtaticity? In: Pure & Applied Chemistry, Vol. 68, 209–218, 1996.
- K. Exner und P. v. R. Schleyer: Theoretical Bond Energies: A critical Evaluation. In: J. Phys. Chem. A 2001, 105, 3407–3416 und zitierte Literatur.
- R. V. Williams, W. D. Edwards, P. Zhang, D. Berg, and R. H. Mitchell: Experimental Verification of the Homoaromaticity of 1,3,5-Cycloheptatriene and Evaluation of the Aromaticity of Tropone and the Tropylium Cation by Use of the Dimethyldihydropyrene Probe. In: Journal of the American Chemical Society 2012 134 (40), 16742–16752.
- H. Prinzbach, G. Gescheidt, H.-D. Martin, R. Herges, J. Heinze, G. K. Surya Prakash, G. A. Olah. „Cyclic electron delocalization in hydrocarbon cages (pagodanes, isopagodanes, (bisseco-/seco-)-(dodecahedradienes))“. In: Pure & Applied Chemistry, Vol. 67, No. 5, S. 673–682, 1995.
- K. Exner, Hochgradig nahgeordnete Bisdiazene und ihre Oxide. Synthese, Photochemie, (Radikal)Kationen, (Radikal)Anionen, Template für Aza-Käfige. Dissertation, Universität Freiburg i. Br., 1998 (PDF).
- K. Exner, D. Hunkler, G. Gescheidt, H. Prinzbach: Do Nonclassical, Cyclically Delocalized 4N/5e Radical Anions and 4N/6e Dianions Exist? – One- and Two-Electron Reduction of Proximate, Synperiplanar Bis-Diazenes. In: Angew. Chem. Indt. Ed. 1998, 37, 1910–1913.
- K. Exner, O. Cullmann, M. Vögtle, H. Prinzbach, B. Grossmann, J. Heinze, L. Liesum, R. Bachmann, A. Schweiger, G. Gescheidt. In: Cyclic In-Plane Electron Delocalization (σ-Bishomoaromaticity) in 4N/5e Radical Anions and 4N/6e Dianions – Generation, Structures, Properties, Ion-Pairing, and Calculations. J. Am. Chem. Soc. 2000, 122, 10650–10660.
- K. Exner, H. Prinzbach, G. Gescheidt, B. Grossmann, J. Heinze. In: Nonclassical, Cyclically Delocalized 4N/3e Radical Cations and 4N/2e Dications: One- and Two-Electron Oxidation of Proximate, syn-Periplanar Bisdiazene Oxides. J. Am. Chem. Soc. 1999, 121, 1964–1965.