Wolffenstein-Böters-Reaktion
Die Wolffenstein-Böters-Reaktion ist eine Namensreaktion der organischen Chemie. Sie dient der Synthese von Dinitrophenol und Trinitrophenol (Pikrinsäure) und wurde nach ihren Entdeckern, den deutschen Chemikern Richard Wolffenstein (1864–1929) und Oskar Böters (1848–1912), benannt.[1][2][3]

Übersichtsreaktion
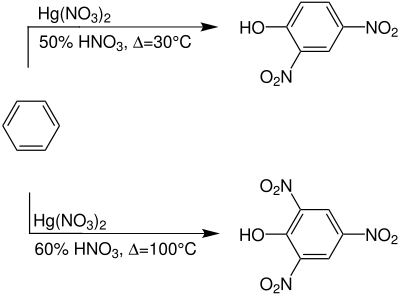
Benzol wird in Anwesenheit von Quecksilber(II)-nitrat mit Salpetersäure umgesetzt. Wird eine 50 %ige Salpetersäure bei 30 °C verwendet, so entsteht Dinitrophenol, mit einer 60 %igen Salpetersäure entsteht bei 100 °C Trinitrophenol:[4][5]
Reaktionsmechanismus
Der nachfolgende Reaktionsmechanismus stammt aus dem Buch „Comprehensive Organic Name Reactions and Reagents“ und ist nur ein möglicher Reaktionsmechanismus:[6]

Das Benzol bildet eine Nebenvalenzbindung mit dem Quecksilber(II)-nitrat aus, in dem die π-Elektronen des Ringsystems in Wechselwirkung mit dem positiv geladenen Quecksilberionen treten. Das hinzugefügte Wasser, addiert sich an das Benzol (1) unter Abspaltung eines Protons. Gleichzeitig bildet sich eine σ-Elektronenbindung vom Benzol zum Quecksilber unter Abspaltung eines Nitratanion. Durch Rearomatisierung wird wieder Salpetersäure abgeschieden und es entsteht Phenol (2).
Wird nun (2) mit Distickstoffpentoxid umgesetzt, welches vorher aus Salpetersäure gewonnen werden muss, in ortho- oder para-Stellung erfolgt eine Nitrierung unter Abspaltung von Salpetersäure. Bei abermaliger Nitrierung durch Distickstoffpentoxid wird die andere Position nitriert, so dass sich 2,4-Dinitrophenol (3) bildet. Abhängig von der Distickstoffpentoxidkonzentration und der Reaktionstemperatur, reagiert es weiter zu 2,4,6-Trinitrophenol (4).
Quecksilberproblematik
Bei dieser Reaktion wird mit Quecksilber gearbeitet, das zu den giftigsten Stoffen gehört. Bei dieser Reaktion liegt der vorgeschlagene Wert bei 0,42 mol auf 100 g Benzol, also 84,24 g. Dabei wird das Quecksilber nahezu verlustfrei wiederaufbereitet.[7][2]
Einzelnachweise
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 3083.
- E. E. Aristoff u. a.: Oxynitration of Benzene to Picric Acid. In: Industrial & Engineering Chemistry. Band 40, Nr. 7, Juli 1948, S. 1281–1290, doi:10.1021/ie50463a024.
- Patent DE194883: Verfahren zur Darstellung von hydroxylierten Nitroverbindungen der aromatischen Reihe. Veröffentlicht am 4. August 1906, Erfinder: Richard Wolffenstein, Oskar Böters.
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 3 Volume Set, John Wiley & Sons, Hoboken, New Jersey 2009, S. 3081, ISBN 978-0-471-70450-8.
- M. Windholz (Hrsg.): The Merck Index, Ninth Edition, Merck & Co., 1976, S. ON-96, ISBN 978-0-911910-26-1.
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 3082.
- F. Kalberlah, M. Schwarz, P. Jennrich: Quecksilber: Die unterschätzte Gefahr. In: Greenpeace. 2015, S. 5,13.