Wender-Indol-Synthese
Die Wender-Indol-Synthese ist eine Namensreaktion der organischen Chemie.[1] Es handelt sich um eine synthetische Methode für Indolderivate, welche 1981 von Paul Anthony Wender (* 1947) beschrieben wurde.[2]
Übersichtsreaktion
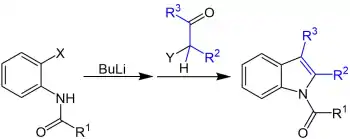
Bei der Wender-Indol-Synthese reagiert das N-Acylorthohaloanilin zunächst mit Butyllithium, um anschließend in einer SN2-Reaktion mit einem α-Haloketon zu dem N-Acylindolderivat zu reagieren. Bei X und Y handelt es sich um die Halogene Chlor, Brom oder Iod.[1][2]
Reaktionsmechanismus
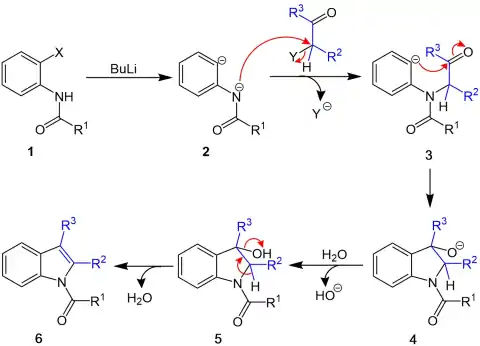
Im vorgeschlagenen Reaktionsmechanismus wird zunächst die starke Base Butyllithium verwendet um aus dem N-Acylorthohaloanilin 1 ein C,N-Dianion 2 herzustellen. 2 reagiert anschließend in einer SN2-Reaktion mit einem α-Haloketon zu dem Zwischenprodukt 3. Das Anion 3 reagiert dann intramolekular unter Bildung des Alkoxids 4. Durch Protonenübertragung entsteht aus 4 das Zwischenprodukt 5, das unter Wasserabspaltung das N-Acylindolderivat 6 liefert. Bei X und Y handelt es sich um die Halogene Chlor, Brom oder Iod.[2][3]
Modifikation
Die Wender-Indol-Synthese wurde erweitert, um N-Dimethylharnstoff geschützte Indole zu synthetisieren. Dafür reagiert N-Phenyl-N,N-dimethylharnstoff zunächst mit einer starken Base zum Dianion, welches durch Abkühlen mit Diethylpyruvat zu Isatin reagiert.[4]
Anwendung
Die Wender-Indol-Synthese wird zur Herstellung von zahlreichen Indolderivaten genutzt.[1]
Einzelnachweise
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Inc., Hoboken, NJ, USA 2010, ISBN 978-0-470-63885-9, S. 2980–2982, doi:10.1002/9780470638859.
- Paul A. Wender, Alan W. White: Methodology for indole synthesis. In: Tetrahedron Letters. Band 22, Nr. 16, 1981, S. 1475–1478, doi:10.1016/S0040-4039(01)90354-5.
- M. Sainsbury: Heterocyclic chemistry. Hrsg.: Royal Society of Chemistry. Royal Society of Chemistry, Cambridge 2001, ISBN 1-84755-106-8, S. 68.
- Keith Smith, Gamal A. El-Hiti, Amba P. Shukla: Variation in site of lithiation with ring substituent of N′-aryl-N,N-dimethylureas: application in synthesis. In: Journal of the Chemical Society, Perkin Transactions 1. Nr. 16, 1999, S. 2305–2313, doi:10.1039/a903464a.