Serini-Reaktion
Die Serini-Reaktion ist eine Namensreaktion der organischen Chemie. Diese wurde von Karl Heinrich Slotta und Klaus Neisser entdeckt und von Arthur Serini[1] (1897–1945) erstmals bei der Erforschung von Steroiden genutzt.[2][3]
Übersichtsreaktion
Mit Hilfe der Serini-Reaktion kann man steroidale 17-Hydroxy-20-essigsäureester in Ketone mit einem unveränderten Steroid-Grundgerüst umwandeln, die zudem am Kohlenstoffatom 17 des Steroids eine Umkehr der Konfiguration erfahren.

Allgemein
Für die Serini-Reaktion wird Toluol als Lösungsmittel genutzt. Die Lösung wird über einen Zeitraum von 4–5 Stunden unter Rückfluss erhitzt. Der Zinkstaub wird im Vorfeld mit Hilfe von verdünnter Salzsäure aktiviert und danach ausgiebig gewaschen und dann getrocknet. Nach der Reaktion wird der Zinkstaub abfiltriert und die Lösung eingedampft.[4]
Reaktionsmechanismus
Der Reaktionsmechanismus der Serini-Reaktion wurde in vielen Abhandlungen kontrovers diskutiert. Ein möglicher Reaktionsmechanismus stellt das Zink als Katalysator dar, der als Lewis-Säure fungiert.[5] Bei diesem würde der Sauerstoff der Carbonylgruppe des am Kohlenstoffatom 20 substituierten Acetats den Zinkstaub nucleophil angreifen. Durch die resultierende positive Ladung kommt es durch Elektronenpaarverschiebungen zur Bildung eines cyclischen Orthoacetat-Anions.


Es bildet sich eine Carbonylverbindung mit dem Kohlenstoffatom 20 und Acetat wird abgespalten. Des Weiteren kommt es zum 1,2-Hydridshift und zur Konfigurationsumkehr am Kohlenstoffatom 17.
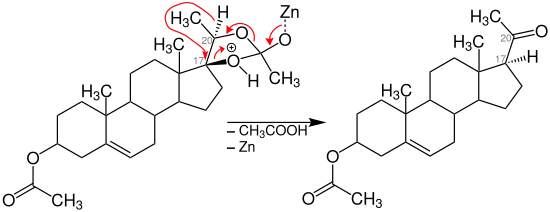
Bei einem anderen vorgeschlagenen Reaktionsmechanismus wird davon ausgegangen, dass es durch reaktives Zink zur Bildung eines Zink-Alkoholats kommt.[4] Bei dieser Variante kommt es als erstes zur Deprotonierung der Hydroxygruppe am Kohlenstoffatom 17. Das entstehende Alkoholat greift nucleophil am Kohlenstoffatom der Carbonylgruppe des Acetats an. Hierbei bildet sich ein cyclisches ortho-Acetat-Anion als Intermediat. Auch bei dieser Variante bildet sich als Nächstes eine Carbonylverbindung mit dem Kohlenstoff 20. Es kommt zum 1,2-Hydridshift mit Konfigurationsumkehr am Kohlenstoffatom 17.
Eine frühere Überlegung, dass sich ein 17,20-Oxid als Intermediat bildet,[6] wurde lange Zeit angenommen, aber letztendlich widerlegt.[7]
Anwendung
Die Serini-Reaktion wird zur Herstellung von Ketonen aus Derivaten des 17-Hydroxy-20-acetoxy-Sterol genutzt. Damit lässt sich die Reaktion für die Totalsynthese von Steroiden nutzen. Des Weiteren lässt sich die Serini-Reaktion auch auf offenkettige trisubstituierte Glykolmonoacetate übertragen, um Ketone zu synthetisieren.[8]
Einzelnachweise
- Arthur Serini, Willy Logemann, Walter Hildebrand: Über die Darstellung von Inhaltsstoffen der Nebennierenrinde. In: Berichte der deutschen chemischen Gesellschaft. 72, 1939, S. 391, doi:10.1002/cber.19390720228.
- Karl Heinrich Slotta, Klaus Neisser: Zur Chemie des Kaffees, IV. Mitteil.: Zur Konstitutionsaufklärung des Cafesterols. In: Berichte der deutschen chemischen Gesellschaft. Band 71, Nr. 11, 1938, S. 2342–2346, doi:10.1002/cber.19380711122.
- C. W. Shoppee: The serini reaction. In: Experientia. Band 4, Nr. 11, 1948, S. 418–420, doi:10.1007/BF02144987.
- G. Goto, K. Yoshioka, K. Hiraga: The serini reaction of 16,17-dihydroxysteroid monoacetates. In: Tetrahedron. Band 30, Nr. 14, 1974, S. 2107–2114, doi:10.1016/S0040-4020(01)97346-6.
- Eugene Ghera: Heterogeneous reactions with zinc. II. General synthesis of ketones from 1,2-trisubstituted glycol monoesters and the mechanism of the serini reaction. In: The Journal of Organic Chemistry. Band 35, Nr. 3, 1970, S. 660–666, doi:10.1021/jo00828a025.
- C. W. Shoppee: 360. Steroids and the Walden inversion. Part V. The Serini reaction. In: Journal of the Chemical Society. 1949, S. 1671–1680, doi:10.1039/JR9490001671.
- Toshio Goto, Louis F. Fieser: Mechanism of the serini reaction. In: Journal of the American Chemical Society. Band 83, Nr. 1, 1961, S. 251–252, doi:10.1021/ja01462a054.
- Helmut Krauch, Werner Kunz: Name reactions and reagents in organic synthesis. 6. Auflage. Wiley-VCH, Weinheim 1997, ISBN 3-527-29713-8, S. 351–353.