Redoxkette
Eine Redoxkette ist eine Verkettung mehrerer Redoxreaktionen mit dem Zweck, Elektronen, die in einer bestimmten ersten Redoxreaktion freigesetzt werden, anschließend mittels verschiedener nachgeschalteter Redoxzyklen bis zu einer zweiten Redoxreaktion „durchzureichen“, wo diese Elektronen dann das betreffende Empfängermolekül reduzieren. Redoxketten sind wichtige Bestandteile zahlreicher biochemischer Mechanismen, zum Beispiel der Photosynthese[1] oder der Atmungskette.[2]
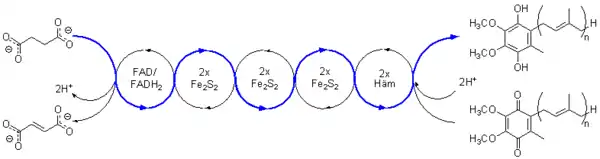
Ablauf
Durch eine chemische Reaktion wird an einer bestimmten Stelle ein Molekül reduziert, das anschließend in einer zweiten Redoxreaktion ein anderes Molekül reduziert und dabei selbst wieder oxidiert wird. Der Elektronenempfänger der zweiten Redoxreaktion wiederholt nun dasselbe in einer weiteren Redoxreaktion mit einem weiteren Empfängermolekül usw., bis die Elektronen schließlich das Kettenende erreichen und dort in einer letzten Redoxreaktion das letztendliche Empfängermolekül reduzieren.
Bedeutung für den Organismus
In den Chloroplasten wird diese Elektronenweitergabe dazu genutzt, H+-Ionen gegen das Konzentrationsgefälle aus dem Stroma in den Thylakoidraum zu transportieren bzw. überhaupt erst einmal ein solches Konzentrationsgefälle zu erzeugen. Durch den entstandenen Protonengradienten entsteht anschließend ein Elektronenfluss, da die H+-Ionen das Bestreben besitzen, wieder von der hohen zur niedrigen Stoffkonzentration zurückzuwandern. Einzige Durchlass-Stelle aber ist dazu ein Tunnelprotein, die ATP-Synthase, und während die H+-Ionen durch die ATP-Synthase strömen, geben sie Energie ab, die zur Bildung von ATP genutzt wird.
Siehe auch
Einzelnachweise
- P. B. Crowley, M. Ubbink: Close encounters of the transient kind: protein interactions in the photosynthetic redox chain investigated by NMR spectroscopy. In: Accounts of chemical research. Band 36, Nummer 10, Oktober 2003, S. 723–730, ISSN 0001-4842. doi:10.1021/ar0200955. PMID 14567705.
- T. E. DeCoursey: Interactions between NADPH oxidase and voltage-gated proton channels: why electron transport depends on proton transport. In: FEBS letters. Band 555, Nummer 1, November 2003, S. 57–61, ISSN 0014-5793. PMID 14630319.