Photosynthetisches Reaktionszentrum
Das photosynthetische Reaktionszentrum ist der zentrale Bestandteil aller Organismen, die Photosynthese betreiben. In jedem Fall handelt es sich um einen Proteinkomplex aus mehreren Untereinheiten. In ihm führt die absorbierte Lichtenergie zu einer Ladungstrennung. So entstehende Elektronen, die ein sehr viel höheres Redoxpotential besitzen, werden dann aus dem Reaktionszentrum abgeleitet und nach vielen Zwischenschritten zur Produktion von Kohlenwasserstoff-Verbindungen benutzt. Das Reaktionszentrum hat sich im Verlauf der Evolution kaum verändert, wohingegen sich die Lichtsammelkomplexe, die es umgeben, verschiedenste Formen angenommen haben. In moderneren Organismen, also Pflanzen, Algen und Cyanobakterien, ist das Reaktionszentrum in einem größeren Komplex, den Photosystemen, einbezogen. In Bakterien lässt sich das Reaktionszentrum isolieren. Im folgenden Abschnitt wird die Funktion des Reaktionszentrums beispielhaft am Reaktionszentrum des Purpurbakteriums Rhodopseudomonas viridis erläutert.
Funktionsweise
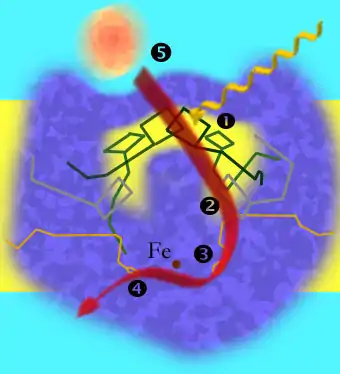
1: Anregung von Elektronen; 2: Weiterleitung der Elektronen zu einem Phaeophytin-Molekül; 3: Übernahme der Elektronen durch ein Ubichinon-Molekül; 4: Übertragung der Elektronen auf das zweite Ubichinon-Molekül; 5: Cytochrome (orange) füllen die Elektronenlücke im positiv geladenen Chlorophyll des special pair wieder auf.[1]
Das Reaktionszentrum von Purpurbakterien ist ein in der Plasmamembran verankerter Komplex aus drei Proteinketten und verschiedenen Pigmenten und wird von einem ringförmigen Lichtsammelkomplex (LH1) umgeben. Die drei Untereinheiten werden mit den Buchstaben L, M und H bezeichnet, wobei letztere aus der Membran herausragt. Die annähernd symmetrisch aufgebauten L- und M-Einheiten befinden sich in der Membran.
Sowohl die L- als auch die M-Einheit enthalten jeweils zwei Bakteriochlorophylle, außerdem ein Phaeophytin und ein Ubichinon. Das Ubichinon-Molekül der M-Einheit kann sich aus dem Komplex lösen. Je ein Bakteriochlorophyll-Molekül der L- und der M-Einheit liegen dicht beieinander und bilden ein sogenanntes "Spezielles Paar" (special pair), an dem die Ladungstrennung stattfindet. Das Bacteriochlorophyll dient der Erweiterung des Absorptionsspektrums, das Maximum wird je nach Art in Bereiche längerwelligen Lichts verschoben, z. B. beim P870 von Rhodobacter sphaeroides hin zu 870 nm und beim P960 von Rhodopseudomonas viridis hin zu 960 nm.
Eines der beiden Bakteriochlorophyll-Moleküle des Speziellen Paars wird in der Regel indirekt durch Aufnahme der Energie von den Antennenpigmenten angeregt, wodurch eine Ladungstrennung entsteht. Das Phaeophytin-Molekül der L-Einheit akzeptiert ein Elektron und wird dadurch zu BPh− reduziert. Nach 200·10−12 Sekunden übernimmt das fest gebundene Ubichinon-Molekül das Elektron. Nach weiteren 200·10−6 Sekunden geht das Elektron auf das Ubichinon-Molekül der M-Einheit über, das, nachdem es auf die gleiche Weise ein zweites Elektron erhalten hat, das Reaktionszentrum verlässt und die Elektronen zum Cytochrom-bc1-Komplex transportiert.
Das fehlende Elektron des Speziellen Paars wird durch ein Cytochrom c, das an das Reaktionszentrum andockt, wieder aufgefüllt.
Die Aufgabe der H-Einheit, die keine Pigmente besitzt, ist bis heute (2006) unklar.
Für die Erforschung des Reaktionszentrums des Purpurbakteriums Rhodopseudomonas viridis, das anoxygene Photosynthese betreibt, erhielten Hartmut Michel, Johann Deisenhofer und Robert Huber den Nobelpreis für Chemie.[2]
Siehe auch
Einzelnachweise
- Couglas C. Youvan und Barry L. Marrs: Molekulare Mechanismen der bakteriellen Photosynthese. In: Spektrum der Wissenschaft. Jg. 1987, Nr. 8, S. 62 ff.
- Informationen der Nobelstiftung zur Preisverleihung 1988 an Hartmut Michel, Johann Deisenhofer und Robert Huber (englisch)