Nekrotisierende Enterokolitis
Die nekrotisierende Enterokolitis (Abkürzung NEC oder NEK) ist eine Erkrankung des Darmes, die als Komplikation bei der Behandlung von sehr kleinen Frühgeborenen mit einem Geburtsgewicht unter 1500 Gramm gefürchtet ist und in dieser Patientengruppe die häufigste akute Erkrankung des Magen-Darm-Traktes überhaupt darstellt. Eine eindeutige Ursache ist nicht bekannt. Es wurden verschiedene Risikofaktoren identifiziert, von denen aber jedem einzelnen keine entscheidende Bedeutung zukommt. Die Behandlung besteht konservativ aus einer Nahrungspause und der Gabe von Antibiotika beziehungsweise beim Auftreten von Komplikationen in der operativen Entfernung der befallenen Darmabschnitte. Somit stellt die nekrotisierende Enterokolitis eine häufige Ursache für ein Kurzdarmsyndrom im Kindesalter dar. Eine Studie aus den Vereinigten Staaten zur Krankenhaussterblichkeit von Frühgeborenen veranschlagt die mit steigendem Geburtsgewicht sinkende Mortalität auf 42 % bei der leichtesten und 16 % bei der schwersten Geburtsgewichtsgruppe.[1]
| Klassifikation nach ICD-10 | |
|---|---|
| P77 | Enterocolitis necroticans beim Feten und Neugeborenen |
| ICD-10 online (WHO-Version 2019) | |
Häufigkeit
Die nekrotisierende Enterokolitis ist am häufigsten für das Auftreten eines akuten Abdomens bei Frühgeborenen verantwortlich. Hauptsächlich tritt sie in der zweiten bis vierten Lebenswoche sehr unreifer Frühgeborenen auf. So ist von allen Frühgeborenen mit einem Geburtsgewicht unter 1500 g etwa jedes zehnte bis zwanzigste – bei konsequenter prophylaktischer Frühtherapie in den ersten 24 Stunden bis hundertsechzigste – von einer nekrotisierenden Enterokolitis betroffen.[2] In den 1990er-Jahren änderte sich an der Häufigkeit des Auftretens trotz verschiedener Fortschritte in der Behandlung von Frühgeborenen nichts.[3] Ungefähr 10 % aller Fälle treten bei reifgeborenen Kindern auf. Auf alle Neugeborenen bezogen beträgt die Häufigkeit 0,3–2,4 Fälle pro 1000 Lebendgeborene mit Schwankungen von Jahr zu Jahr und von Behandlungszentrum zu Behandlungszentrum.[4]
Ursache
Die Entstehung einer nekrotisierenden Enterokolitis ist immer noch nicht eindeutig geklärt. Volumenmangelschock, offener Ductus arteriosus Botalli, Erniedrigung des Blutdrucks, Herzfehler mit Verengung des linken Ausflusstraktes, wie eine Aortenisthmusstenose, Atemnotsyndrom mit Sauerstoffmangel im Blut, Unterkühlung, Unterzuckerung, gesteigerte Anzahl roter Blutkörperchen, Einlegen eines Katheters in die Nabelschnurgefäße, verschiedene Infektionen und die Gabe von hochkonzentrierten (hyperosmolaren) Nährlösungen und Medikamenten sind als Risikofaktoren benannt worden. Keinem dieser bekannten Risikofaktoren kommt jedoch einzeln eine besondere Bedeutung zu. Möglicherweise sind sie nur Ausdruck einer allgemeinen Hochrisikogruppe für Komplikationen.[4] Lange Zeit umstritten war die Frage, ob eine frühzeitige enterale (über den Magen-Darm-Trakt) Ernährung aufgrund der Unreife des Darmes einen Risikofaktor für die Entwicklung einer NEC darstellt. Nachdem ältere Studien dies nahelegten, konnte dies in neueren Studien widerlegt werden.[3]
Pathologie
In einem komplexen Zusammenspiel aus Schädigung der Darmwand durch verminderte Durchblutung (Minderperfusion) und Infektion kommt es zu einem Gewebsuntergang (Nekrose) in der Darmwand, meist im Bereich des terminalen Ileum und des Colon ascendens, mit Einlagerung von Fäulnisgasen in die Darmwand (Pneumatosis intestinalis). Schreitet die Schädigung voran kann die Darmwand auch perforieren und es entsteht durch austretenden Darminhalt eine Entzündung der Bauchhöhle, speziell des Bauchfells (Peritonitis). Eine Sepsis ist die Folge.
Symptome
Hauptanzeichen für die nekrotisierende Enterokolitis ist ein geblähter Bauch mit erweiterten Darmschlingen, die aufhören, sich zu bewegen, und unter der Bauchdecke sichtbar werden (Darmsteifungen). Die Nahrung wird nicht mehr vertragen und die Neugeborenen erbrechen gallig blutigen Magensaft. In der Regel haben die Kinder keinen Stuhlgang mehr oder, falls doch, weist der Stuhl kleine Blutbeimengungen auf. Breitet sich der Infekt von den Darmschlingen im ganzen Körper aus, sodass eine Sepsis entsteht, kommen bei den Neugeborenen die allgemeinen Krankheitszeichen der Sepsis hinzu. Dazu gehören eine schmutzig-graue Hautfarbe, eine eingeschränkte Durchblutung in der Haut, Atem- und Kreislaufstörungen. Schreitet die Erkrankung weiter fort wird der Bauch druckschmerzhaft und die Muskeln der Bauchdecke spannen sich zur Abwehr an (Abwehrspannung), was auf eine Entzündung des Bauchfells, eine Peritonitis, hinweist. Eine Rötung der Flanken stellt schon ein spätes Zeichen einer Bauchfellentzündung dar und weist häufig darauf hin, dass sich in der beschädigten Darmwand ein Loch gebildet hat.[4]
Diagnose und Differenzialdiagnose
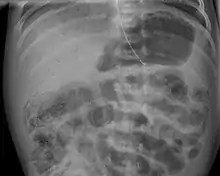
Neben der wiederholten körperlichen Untersuchung den Blutuntersuchungen sowie Abnahme von Blutkulturen kommen verschiedene apparative Untersuchungsverfahren zum Einsatz. Im Röntgenbild des Bauchraumes stellen sich die Darmschlingen erweitert und die Darmwände verdickt dar und man kann bei einer Pneumatosis intestinalis gegebenenfalls die Gasbläschen in der Darmwand und den Darmvenen, die in die Leberpforte ziehen (Portalvenen), als Aufhellungspunkte sehen. Bei einer schon eingetretenen Perforation ist auch freie Luft in der Bauchhöhle zu erkennen. Auch im Ultraschall stellen sich die Darmwände verdickt dar und Luftbläschen in der Darmwand und in den Portalvenen sind erkennbar. Eine mögliche mitverursachende Infektion kann durch eine Blutkultur und entsprechende Stuhluntersuchungen nachgewiesen werden.[4]
Die nekrotisierende Enterokolitis muss bei entsprechender Symptomatik gegen einen Mekoniumpfropf, angeborene Fehlbildungen des Magen-Darm-Traktes und Darmperforationen anderer Ursache mit Mikrokolon, auch solcher, die durch ärztliche Maßnahmen (iatrogen) entstanden sind, abgegrenzt werden.[4]
Therapie
Bei sicherer Diagnose muss die Ernährung über den Magen-Darm-Trakt für bis zu zehn Tage eingestellt und vollständig über Infusionen gewährleistet werden (totale parenterale Ernährung). Eine Behandlung mit Antibiotika erfolgt wie auch sonst bei einer Sepsis im Neugeborenenalter. Der Kreislauf soll zur Verbesserung der Durchblutung der Darmwand durch Volumengaben und möglicherweise auch das Katecholamin Dopamin in niedriger Dosierung unterstützt werden.[4] Meist ist eine künstliche Beatmung notwendig. Der Nahrungsaufbau kann ganz vorsichtig erfolgen, wenn der Bauch klinisch wieder unauffällig ist. Bei einer Perforation oder einer Bauchfellentzündung (Peritonitis) ist eine operative Therapie durch Kinderchirurgen erforderlich. Die soll besser frühzeitig erfolgen, damit dabei möglichst wenig betroffene Darmanteile entfernt werden müssen. Es wird vorübergehend ein künstlicher Darmausgang (Enterostoma) angelegt. 8–10 Tage nach der Operation kann begonnen werden den zum After führenden Schenkel des Anus praeter mit Traubenzuckerlösung und später auch Milchnahrung oder besser noch Stuhl aus dem zuführenden Schenkel zu spülen.[4]
Forscher arbeiten an neuen Therapiemöglichkeiten für die Erkrankung, so wird zum Beispiel versucht Stammzellen aus dem Fruchtwasser zu verwenden, um die Erkrankung besser kurieren zu können. Zumindest im Versuch mit Ratten konnten Erfolge erzielt werden[5].
Prognose
Die Prognose hängt davon ab, wie schnell das vorliegen der nekrotisierenden Enterokolitis und der daraus folgenden Sepsis erkannt und mit der Behandlung begonnen wird. Kann die Sepsis mit Medikamenten gut kontrolliert werden, ist die Prognose des betroffenen Neugeborenen nicht schlecht. Es sterben etwa fünf bis zehn Prozent der von einer nekrotisierenden Enterokolitis betroffenen Neugeborenen. Haben sich die Nekrosen auf einen großen Darmabschnitt ausgedehnt, der, wenn er sich nicht erholt, entfernt werden muss, entwickelt sich bei dem Kind ein Kurzdarmsyndrom.
Prophylaxe
Als vorbeugende Maßnahmen hat man versucht, Frühgeborenen Antikörper von Blutspendern (Immunglobuline) entweder über die Vene oder auch oral zu verabreichen. Die vorbeugende Wirkung ist jedoch nicht ausreichend gesichert. Eine vorbeugende Behandlung mit oralen Antibiotika verringert das Risiko einer nekrotisierenden Enterokolitis, wird aber wegen der Erzeugung von Resistenzen nicht routinemäßig angewendet. Die Gabe von Erythropoetin soll der NEC wegen der Verbesserung der Sauerstoffversorgung und eines Zelluntergangsschutzes (Apoptose) vorbeugen können. Muttermilch enthält verschiedene Faktoren, die vor einer NEC schützen können, wobei man beachten muss, dass diese Faktoren wahrscheinlich durch Pasteurisierung zerstört werden.[4] Möglicherweise sind Medikamente, die bestimmte natürliche Darmbakterien (Probiotika) oder Substanzen, die das Wachstum dieser Bakterien gezielt fördern (Präbiotika) durch die Förderung einer natürlichen Besiedlung des Darmes von Frühgeborenen in der Lage, die Häufigkeit einer NEC zu reduzieren. Dies ist Gegenstand gegenwärtiger Studien.[3]
Literatur
- Friedrich Carl Sitzmann (Hrsg.): Pädiatrie. 2., vollständig überarbeitete Auflage. Georg Thieme Verlag, Stuttgart 2002, ISBN 3-13-125332-0, S. 124–126.
- Monica Epelman u. a.: Necrotizing Enterocolitis: Review of State-of-the-Art Imaging Findings with Pathologic Correlation. In: RadioGraphics. 2007, 27, S. 2, 285–305, Radiologische und histologische Bilder (englisch) abgerufen am 11. Januar 2014, doi:10.1148/rg.272055098
Weblinks
Einzelnachweise
- Mortality of necrotizing enterocolitis expressed by birth weight categories. In: Journal of Pediatric Surgery. Volume 44, Issue 6, June 2009, S. 1074. (Abstract)
- Dietrich von Schweinitz, Benno Ure: Kinderchirurgie: Viszerale und allgemeine Chirurgie des Kindesalters. Springer-Verlag, 2013, ISBN 978-3-642-29779-3 (google.de [abgerufen am 9. November 2016]).
- W. A. Mihatsch u. a.: Frühzeitige enterale Ernährung bei sehr kleinen Frühgeborenen ist nicht mit nekrotisierender Enterokolitis assoziiert. In: Monatsschrift Kinderheilkunde. 2002, 150, S. 724–733.
- R. Roos u. a.: Checkliste Neonatologie. Das Neo-ABC. Georg Thieme Verlag, Stuttgart 2001, ISBN 3-13-125051-8.
- A. Zani, M. Cananzi, F. Fascetti-Leon, G. Lauriti, V. V. Smith, S. Bollini, M. Ghionzoli, A. D Arrigo, M. Pozzobon, M. Piccoli, A. Hicks, J. Wells, B. Siow, N. J. Sebire, C. Bishop, A. Leon, A. Atala, M. F. Lythgoe, A. Pierro, S. Eaton, P. De Coppi: Amniotic fluid stem cells improve survival and enhance repair of damaged intestine in necrotising enterocolitis via a COX-2 dependent mechanism. In: Gut. doi:10.1136/gutjnl-2012-303735.